
【题目】当光束通过下列分散系时,能观察到丁达尔效应的是( )
A.淀粉溶液
B.泥水
C.NaCl 溶液
D.浓盐酸
 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:
【题目】25℃时,向100 mL 0.1 molL-1 NH4HSO4溶液中滴加0.1 molL-1 NaOH溶液,得到的溶液pH与NaOH溶液体积的关系曲线如图(H2SO4视为二元强酸)。下列说法错误的是( )

A. a点时溶液的pH<1
B. a点到b点的过程中,溶液的导电能力减弱
C. ab段上的点(不包括a点)均满足关系式:c(NH4+)+c(Na+)<2c(SO42-)
D. b点时离子浓度大小顺序为:c(Na+)>c(SO42-)>c(NH4+)> c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(2014·课标全国卷Ⅰ,11,6分)溴酸银(AgBrO3)溶解度随温度变化曲线如图所示,下列说法错误的是( )

A.溴酸银的溶解是放热过程
B.温度升高时溴酸银溶解速度加快
C.60 ℃时溴酸银的Ksp约等于6×10-4
D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①0.001 mol/L的A溶液pH=3;
②B溶液和D溶液显碱性,等浓度两者PH关系B< D;
③E是弱电解质。回答下列问题:
(1)D是____________溶液。
(2)用水稀释0.1 mol·L-1 B时,溶液中随着水量的增加而减小的是________(填写序号)。
①c(B)/c(OH-)
②c(OH-)/c(H+)
③c(H+)和c(OH-)的乘积
④OH-的物质的量
(3)将等体积、等物质的量浓度B和C的溶液混合,升高温度(溶质不会分解)溶液pH随温度变化为图中的________曲线(填写序号)。

(4)OH-浓度相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是________(填写序号)。
①反应所需要的时间E>A ②开始反应时的速率A>E
③参加反应的锌的物质的量A=E ④反应过程的平均速率E>A
⑤A溶液里有锌剩余 ⑥E溶液里有锌剩余
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.某二元酸(化学式用H2A表示)在水中的电离方程式是:H2A = H+ + HA-,HA-![]() H++A2-。回答下列问题:
H++A2-。回答下列问题:
(1)在0.1mol·L-1的Na2A溶液中,下列微粒浓度关系不正确的是_________。
A.c(A2-)+c(HA-)+c(H2A)=0.1mol·L-1
B.c(OH-)=c(H+)+c(HA-)
C.c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-)
D.c(Na+)=2c(A2-)+2c(HA-)
(2)已知0.1mol·L-1NaHA溶液的pH=2,则0.1mol·L-1H2A溶液中氢离子的物质的量浓度________(填“>”、“<”或“=”)0.11mol·L-1。
II.亚磷酸(H3PO3)是二元酸,H3PO3溶液存在电离平衡:H3PO3![]() H+ +H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
H+ +H2PO3-。亚磷酸与足量NaOH溶液反应,生成Na2HPO3。
(1)①某温度下,0.1000 mol·L-1的H3PO3溶液中c (H+) = 2.5×10-2mol·L-1,除OH-之外其他离子的浓度由大到小的顺序是 ,
②写出亚磷酸与少量NaOH溶液反应的离子方程式 。
III.“低碳经济”时代,科学家利用“组合转化”等技术对CO2进行综合利用。
(1)CO2和H2在一定条件下可以生成乙烯:6H2(g)+2CO2(g)![]() CH2==CH2(g)+4H2O(g) △H=a kJ·mol-1 已知:H2(g)的燃烧热为285.8 kJ·mol-1,CH2=CH2(g)的燃烧热为1411.0 kJ·mol-1,H2O(g)= H2O(l) △H=-44.0 kJ·mol-1,则a=______kJ·mol-1。
CH2==CH2(g)+4H2O(g) △H=a kJ·mol-1 已知:H2(g)的燃烧热为285.8 kJ·mol-1,CH2=CH2(g)的燃烧热为1411.0 kJ·mol-1,H2O(g)= H2O(l) △H=-44.0 kJ·mol-1,则a=______kJ·mol-1。
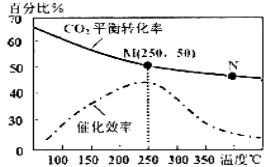
(2)上述生成乙烯的反应中,温度对CO2的平衡转化率及催化剂的催化效率影响如右上图,下列有关说法不正确的是_______(填序号)
①温度越高,催化剂的催化效率越高
②M点平衡常数比N点平衡常数大
③温度低于250℃时,随着温度升高,乙烯的产率增大
④增大压强可提高乙烯的体积分数
⑤N点正反应速率一定大于M点正反应速率
IV.为减轻大气污染,可在汽车尾气排放处加装催化转化装置,反应方程式为:
2NO(g)+2CO(g)![]() 2CO2(g)+N2(g)。
2CO2(g)+N2(g)。
(3)若在500℃时,投料![]() =1 且NO的起始浓度为amol/L,NO的转化率为80%,则此温度时的平衡常数K=________。
=1 且NO的起始浓度为amol/L,NO的转化率为80%,则此温度时的平衡常数K=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,可逆反应2A![]() B+3C,在以下四种情况中处于平衡状态的是( )
B+3C,在以下四种情况中处于平衡状态的是( )
正反应速率 | 逆反应速率 | |
A | v(A)=2 mol·L-1·min-1 | v(B)=2 mol·L-1·min-1 |
B | v(A)=2 mol·L-1·min-1 | v(C)=2 mol·L-1·min-1 |
C | v(A)=1 mol·L-1·min-1 | v(B)=2 mol·L-1·min-1 |
D | v(A)=1 mol·L-1·min-1 | v(C)=1.5 mol·L-1·min-1 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】PbO主要用做电子管、显像管、光学玻璃和防X射线的铅玻璃的原料,它是一种难溶于水,密度较大的固体。下图是用某工业废渣(含PbSO435%,其余为CaSO4)生产PbO的主要流程。
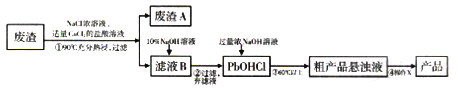
已知:从液体中分离出密度较大且不溶的固体常用倾析法,即先使固体沉降,再将上层溶液倾倒入另一容器。
根据以上流程回答下列问题:
(1)废渣A的主要成分是__________________(填化学式)。
(2)PbSO4在热的NaCl浓溶液中溶解生成PbCl42-,则①中反应的离子方程式为_______;加入CaCl2的目的是________________。
(3)“滤液B→PbOHCl”的离子方程式为_________________。
(4)已知NaOH浓溶液有强烈的腐蚀性,会腐蚀滤纸。所以,从粗产品悬浊液提取最终产品的操作X依序是(填操作名称)__________、___________、过滤、干燥。
(5)为了测定产品中PbO的纯度,取0.4g研细的产品于锥形瓶中,加入水和36%的乙酸溶液,温热使产品溶解,冷却后加入缓冲溶液和指示剂,用浓度为0.2000mol/L的EDTA(用H2Y表示)溶液滴定到终点,消耗EDTA溶液8.30mL,计算产品中PbO的纯度为_______(保留三位有效数字)。(已知:Pb2++H2Y=PbY+2H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五种短周期元素X、Y、Z、W、Q的原子序数依次增。X、Y是非金属元素X、Y、Q元素的原子最高能级上电子数相等;Z元素原子的最外层电子数是次外层的两倍;W元素原子核外有三种不同的能级且原子中p亚层与s亚层电子总数相等;Q元素电离能分别是I1=496,I2=4562,I3=6912。回答下列问题:
(1)基态Q原子的核外电子排布式是____________________。
(2)Q、W形成的化合物Q2W2中的化学键类型是______________。
(3)Y能与氟元素形成YF3,该分子的空间构型是_______,该分子属于______分子(填“极性”或“非极性”)。Y与X可形成具有立体结构的化合物Y2X6,该结构中Y采用______杂化。
(4)Y(OH)3是一元弱酸,其中Y原子因缺电子而易形成配位键,写出Y(OH)3在水溶液中的电离方程式_______________。
(5) Z的一种单质晶胞结构如下图所示。
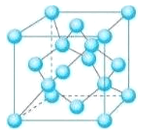
①该单质的晶体类型为___________。
②含1 mol Z原子的该晶体中共有_____mol化学键。
③己知Z的相对原子质量为M,原子半径为r pm,阿伏伽德罗常数的值为NA,则该晶体的密度为____g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列物质:维生素A、维生素C、碘元素、铁元素、淀粉、油脂。请选择正确答案填在相应的空格里。
①人体缺乏某种维生素会引起坏血病,这种维生素是__________。
②人体缺乏某种微量元素会发生贫血,这种微量元素是__________。
③既能为人体提供热量,又能提供必需脂肪酸的物质是__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com