
【题目】X、Y、Z、M、R是原子序数依次增大的短周期主族元素,X在周期表中原子半径最小,Y与Z相邻,Z、R在地壳中的含量位列前两位,M为短周期中电负性最小的元素。请回答:
(1)基态Z原子的外围电子排布图为____________。
(2)X与Y能形成多种化合物,其中Y2X2分子中σ键、π键的数目之比为_______。
(3)在R3Y4晶体中键角:Y-R-Y____R-Y-R(填“>”“<”或“=”),原因为________。
(4)钨(W)元素可以和Z、M形成多种化合物,其中一种化合物的晶体结构如图:

已知:相邻Z原子的核间距为apm,钨原子位于Z原子形成的正八面体的体心,M离子位于钨原子形成的立方体的体心。
①与M原子距离最近且相等的Z原子的数目为_________。
②晶体的化学式为__________。
③设NA为阿伏加德罗常数的值,则晶体的密度为______g/cm3(列出表达式)。
【答案】 ![]() 3:1 > Si3N4晶体中Si和N原子均为sp3杂化,但N原子含有1对孤对电子,孤对电子对成键电子的排斥作用更大,使得Si—N—Si键角小于109°28′ 12 NaWO3
3:1 > Si3N4晶体中Si和N原子均为sp3杂化,但N原子含有1对孤对电子,孤对电子对成键电子的排斥作用更大,使得Si—N—Si键角小于109°28′ 12 NaWO3 ![]()
【解析】X、Y、Z、M、R是原子序数依次增大的短周期主族元素,X在周期表中原子半径最小,X为H元素;Z、R在地壳中的含量位列前两位,则Z为O元素,R为Al元素;Y与Z相邻,则Y为N元素,M为短周期中电负性最小的元素,即金属性最强的元素,M为Na元素。
(1)Z为O元素,基态O原子的外围电子排布图为![]() ,故答案为:
,故答案为:![]() ;
;
(2)X与Y能形成多种化合物,其中Y2X2为H2N2,结构为H-N=N-H分子中σ键、π键的数目之比为3:1,故答案为:3:1;
(3)Si3N4晶体中Si和N原子均为sp3杂化,但N原子含有1对孤对电子,孤对电子对成键电子的排斥作用更大,使得Si—N—Si键角小于109°28′,故答案为:> ;Si3N4晶体中Si和N原子均为sp3杂化,但N原子含有1对孤对电子,孤对电子对成键电子的排斥作用更大,使得Si—N—Si键角小于109°28′;
(4)①钨原子位于Z原子形成的正八面体的体心,被6个氧离子包围成配位八面体;钠离子位于钨原子形成的立方体的体心,被12个氧离子包围,故答案为:12;
②钛离子位于立方晶胞的角顶,被6个氧离子包围成配位八面体;钙离子位于立方晶胞的体心,被12个氧离子包围;每个晶胞中钛离子和钙离子均为1个,晶胞的12个边长上各有一个氧原子,根据均摊原则,每个晶胞实际占有氧原子数目为12×![]() =3,则晶胞的化学式为NaWO3,故答案为:NaWO3;
=3,则晶胞的化学式为NaWO3,故答案为:NaWO3;
③相邻Z原子的核间距为apm=a×10-10cm,则晶胞的边长为2×![]() a×10-10cm=
a×10-10cm=![]() a×10-10cm ,则晶体的密度为
a×10-10cm ,则晶体的密度为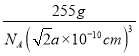 =
= g/cm3,故答案为:
g/cm3,故答案为: 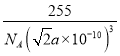 。
。


 轻松夺冠全能掌控卷系列答案
轻松夺冠全能掌控卷系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E代表前四周期原子序数依次增大的五种元素。A、D同主族且有两种常见化合物DA2和DA3;工业上电解熔融C2A3制取单质C, B、E除最外层均只有2个电子外,其余各层全充满,E位于元素周期表的ds区。回答下列问题:
(l) B、C中第一电离能较大的是_________,基态D原子价电子的轨道表达式为_______
(2) DA2分子的VSEPR模型是________。H3A比H2D熔沸点高得多的原因是_________。
(3)实验测得C与氯元素形成化合物的实际组成为C2Cl6,其球棍模型如图所示。已知C2Cl6在加热时易升华,与过量的NaOH 溶液反应可生成Na[C(OH)4]

①C2Cl6属于_________晶体(填晶体类型),其中C原子的杂化轨道类型为______杂化。
②[C(OH)4]-中存在的化学健有__________。
(4)工业上制备B的单质是电解熔融B的氯化物,而不是电解BA,原因是_________。
(5)B、C的氯化物晶格能分别是2957KJ/mol、5492KJ/mol,二者相差很大的原因是________。
(6)D与E所形成化合物晶体的晶胞如右图所示。

①在该晶胞中,E的配位数为__________。
②原子坐标参数可表示晶胞内部各原子的相对位置。右图晶胞中,原子坐标参数a为(0,0,0);b为(1/2,0,1/2),c为(1/2,1/2,0).则d原子的坐标为__________。
③已知该晶胞的密度为ρg/cm3,则其中两个D,原子之间的距离为____pm(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,a、b、c均为非金属单质,d、e均为含有10个电子的共价化合物,且分子中所含原子个数:d>e,f为离子化合物。则下列说法错误的是

A. 常温下,单质a呈气态 B. 单质c的水溶液具有漂白性
C. 稳定性:d< e D. f受热易分解为d和e
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
(1)按官能团的不同,可以对有机物进行分类,请指出下列有机物的种类,填在横线上。
① ![]() __________; ②
__________; ② ![]() ___________;
___________;
③![]() ____________ ;④
____________ ;④![]() ;
;
⑤![]() ___________;
___________;
(2)某烃A 0.2 mol在氧气中充分燃烧后,生成化合物B、C各1 mol。
①烃A的分子式为 。
②若烃A不能使溴水褪色,但在一定条件下,能与Cl2发生取代反应,其一氯代物只有一种,则A的结构简式为 。
③若烃A能使溴水褪色,在催化剂作用下与H2加成,其加成产物分子中含有3个甲基,则A可能的结构简式为 ;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值。下列说法正确的是
A. 14g分子式为CnH2n的链烃中含有的C—H键的数目为2NA
B. 0.1molCl2与足量石灰乳反应,转移电子的数目为0.2NA
C. 室温下,l L pH =13的NaOH溶液中,由水电离出的OH-离子数目为0.1NA
D. 标准状况下,2.24 LNO2和N2O4混合气体中含有氧原子数目为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种物质之间的转化关系如图所示(部分产物已略去),下列说法正确的是( )

A. 若A为AlCl3溶液,B可能为氨水,反应①的离子方程式为:A13++4NH3·H2O=AlO2+ 4NH4++2H2O
B. 若A为Fe,B可能为稀硝酸,反应②的离子方程式为: 3Fe+8H++2NO3=3Fe2++2NO↑+4H2O
C. 若A为NaOH溶液,B可能为CO2,可用Ca(OH)2溶液鉴别C、D溶液
D. 若A为Cl2,B可能为NH3,实验室可用加热固体C的方法制取NH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体数目的叙述中,不正确的是
A. 戊烷有3种同分异构体
B. C8H10中只有3种属于芳香烃的同分异构体
C. 甲苯苯环上的一个氢原子被含3个碳原子的烷基取代,所得产物有6种
D. CH3CH2CH2CH3光照下与氯气反应,只生成2种一氯代烃
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E是前四周期原子序数依次增大的五种元素。A元素原子的核外电子数等于其电子层数,B元素基态原子有三个能级且各能级电子数相同, A与D可形成两种常见液态化合物G、H,其原子数之比分别为1:1和2:1。E元素原子的K、L层电子数之和等于其M、N层电子数之和。请回答下列各题(涉及元素请用相应化学符号表示):
(1) B、C、D三种元素中电负性最大的元素其基态原子的电子排布图为 。
(2)处于一定空间运动状态的电子在原子核外出现的概率密度分布可用 形象化描述。在B的基态原子中,核外存在 对自旋相反的电子。
(3)由E和D形成的晶胞如图1所示,晶体中E2+周围等距且最近的E2+有________个;ED的焰色反应为砖红色,许多金属或它们的化合物都可以发生焰色反应,其原因是 。E和B可形成的晶体的晶胞结构与NaCl晶体的相似(如图2所示),但该晶体中含有的哑铃形B22-的存在,使晶胞沿一个方向拉长。晶体中E2+的配位数为______。该化合物的电子式为 。
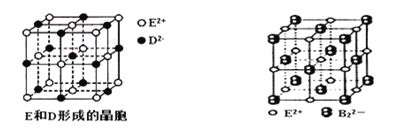
(4)用高能射线照射液态H时,一个H分子能释放出一个电子,同时产生一种阳离子。
①释放出来的电子可以被若干H分子形成的“网”捕获,你认为H分子间能形成“网”的原因是 。
②由H分子释放出一个电子时产生的一种阳离子具有较强的氧化性,试写出该阳离子与SO2的水溶液反应的离子方程式 ;
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com