
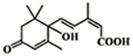
 大量盆栽鲜花因施用了S-诱抗素制剂,得以保证鲜花盛开,S-诱抗素的分子结构如图,下列关于该分子的说法正确的是( )
大量盆栽鲜花因施用了S-诱抗素制剂,得以保证鲜花盛开,S-诱抗素的分子结构如图,下列关于该分子的说法正确的是( )| A. | 1mol该物质与足量的NaOH溶液反应最多消耗2mol NaOH | |
| B. | 该物质在Cu作催化剂条件下能被催化氧化 | |
| C. | 该物质能发生氧化、还原、取代反应 | |
| D. | 分别与足量的Na、NaHCO3 反应生成的气体在相同状况下体积比为2:1 |
分析 该物质中含有羰基、碳碳双键、醇羟基、羧基,具有酮、烯烃、醇和羧酸性质,能发生加成反应、加聚反应、氧化反应、酯化反应、取代反应等,据此分析解答.
解答 解:A.只有羧基能和NaOH反应,则1mol该物质与足量的NaOH溶液反应最多消耗1mol NaOH,故A错误;
B.连接醇羟基碳原子上不含H原子,所以不能发生催化氧化,故B错误;
C.碳碳双键能发生氧化反应、加成反应,醇羟基和羧基能发生取代反应,故C正确;
D.醇羟基和羧基能和Na反应,只有羧基能和碳酸氢钠反应,则1mol该物质分别与Na、碳酸氢钠反应生成气体的物质的量分别是1mol、1mol,所以分别与足量的Na、NaHCO3 反应生成的气体在相同状况下体积比为1:1,故D错误;
故选C.
点评 本题考查有机物结构和性质,为高频考点,明确官能团及其性质关系是解本题关键,注意醇发生催化氧化反应结构特点,易错选项是B.


科目:高中化学 来源: 题型:解答题
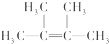 ;
;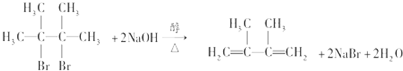 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
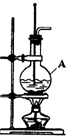 在实验室制取乙烯的装置图(如图)中,
在实验室制取乙烯的装置图(如图)中,查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  | B. |  | C. |  | D. |  |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硅酸钠溶液与醋酸溶液混合:SiO32-+2H+=H2SiO3↓ | |
| B. | NaHCO3溶液中加入过量的 Ba(OH)2溶液:HCO3-+Ba2++OH-=BaCO3↓+H2O | |
| C. | 氯化铝溶液中加入过量氨水 Al3++4NH3•H2O=AlO2-+4NH4++2H2O | |
| D. | 用稀HNO3溶液FeS固体:FeS+2H+=Fe2++H2S↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 6.02×1023b2/n | B. | b2/n | C. | n/b2 | D. | 6.02×1023b |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com