
【题目】甲、乙、丙三种物质存在如图所示的转化关系(图中“→”表示一步转化)。下列各组物质转化,不能满足此关系的是

甲 | 乙 | 丙 | |
A | NaOH | Na2CO3 | NaHCO3 |
B | AlCl3 | Al(OH)3 | NaAlO2 |
C | NH3 | N2 | HNO3 |
D | S | SO2 | H2SO4 |
A. A B. B C. C D. D
【答案】C
【解析】A.甲→乙,2NaOH+CO2![]() Na2CO3+H2O,乙
Na2CO3+H2O,乙![]() 丙,Na2CO3+H2O+CO2
丙,Na2CO3+H2O+CO2![]() 2NaHCO3,2NaHCO3
2NaHCO3,2NaHCO3![]() Na2CO3+H2O+CO2↑,甲+丙→乙,NaHCO3+NaOH
Na2CO3+H2O+CO2↑,甲+丙→乙,NaHCO3+NaOH![]() Na2CO3+H2O ,故A不符合题意;B. 甲→乙,AlCl3+3NaOH
Na2CO3+H2O ,故A不符合题意;B. 甲→乙,AlCl3+3NaOH![]() Al(OH)3↓+3NaCl,乙
Al(OH)3↓+3NaCl,乙![]() 丙,Al(OH)3+NaOH
丙,Al(OH)3+NaOH![]() NaAlO2+2H2O,NaAlO2+HCl+H2O
NaAlO2+2H2O,NaAlO2+HCl+H2O![]() Al(OH)3↓+NaCl,甲+丙→乙,3NaAlO2+AlCl3
Al(OH)3↓+NaCl,甲+丙→乙,3NaAlO2+AlCl3![]() 4Al(OH)3↓+3NaCl ,故B不符合题意; C. 乙→丙,不能一步转化,故C符合题意;D.甲→乙,S+ O2
4Al(OH)3↓+3NaCl ,故B不符合题意; C. 乙→丙,不能一步转化,故C符合题意;D.甲→乙,S+ O2![]() SO2,乙
SO2,乙![]() 丙,SO2+H2O2
丙,SO2+H2O2![]() H2SO4,C+2H2SO4(浓)
H2SO4,C+2H2SO4(浓)![]() CO2↑+2SO2↑+2H2O,甲+丙→乙,S+2H2SO4(浓)
CO2↑+2SO2↑+2H2O,甲+丙→乙,S+2H2SO4(浓) ![]() 3SO2↑+2H2O,故D不符合题意。故选C。
3SO2↑+2H2O,故D不符合题意。故选C。


科目:高中化学 来源: 题型:
【题目】实验室从溶液中获取固体溶质,常见的方法是蒸发,一般有以下操作过程:①放置蒸发皿;②固定铁圈位置;③放置酒精灯;④停止加热,余热蒸干;⑤加热搅拌。其正确的操作顺序为( )
A.①③②④⑤B.①②③④⑤C.②③①⑤④D.③②①⑤④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 元素的第一电离能越大,其金属性一定越强
B. 元素的第一电离能越小,其金属性一定越强
C. 金属单质跟酸反应的难易,只跟该金属元素的第一电离能有关
D. 金属单质跟酸反应越容易,表明元素的电负性越小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】和硅同一主族的锗也是重要的半导体材料,锗应用于航空航天测控、光纤通讯等领域。一种提纯二氧化锗粗品(主要含GeO2、As2O3)的工艺如下:

已知:①“碱浸”过程中的反应为:GeO2+2NaOH=Na2GeO3+H2O、As2O3+2NaOH=2NaAsO2+H2O
② GeCl4的熔点为-49.5℃,AsCl3与GeCl4的沸点分别为130.2℃、84℃。
(1)砷的原子序数为33,砷在元素周期表中的位置为第______周期第________族。
(2)“氧化除砷”的过程是将NaAsO2氧化为Na3AsO4,其反应的离子方程式为:___________________________________________________________________。
(3)传统的提纯方法是将粗品直接加入盐酸中蒸馏,其缺点是_________________。
(4)“蒸馏”过程中的反应的化学方程式为:________________________________。
(5)“水解”操作时保持较低温度有利于提高产率,其最可能的原因是_____________(答一条即可)。
(6)若1吨二氧化锗粗品(含杂质30%)经提纯得0.745吨的较纯二氧化锗产品,则杂质脱除率为_________。
(7)和砷同一主族的锑也可以用于半导体中。一种突破传统电池设计理念的镁—锑液态金属二次电池工作原理如图所示:

该电池由于密度的不同,在重力作用下分为三层,工作时中间层熔融盐的组成不变。充电时,C1-向______(填“上”或“下”)移动;放电时,正极的电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关叙述或判断错误的是
A. Ca(ClO)2可用作饮用水的消毒剂
B. BaCO3可用作肠胃检查的内服剂
C. 锅炉中的CaSO4水垢可用Na2CO3溶液处理,再用酸除去
D. ZnCl2浓溶液可用于去除待焊金属表面的氧化物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】拆开1 mol 共价键所吸收的能量或形成1 mol 共价键所释放的能量称为键能。已知:H-H键能为436 kJ /mol,H-N键能为391 kJ /mol, N2 (g)+ 3H2(g) ![]() 2NH3(g) △H=-92.4 kJ /mol,下列说法中正确的是( )
2NH3(g) △H=-92.4 kJ /mol,下列说法中正确的是( )
A. H-H比N≡N更牢固
B. N≡N键能约为946 kJ/mol
C. 合成氨反应选择适当的催化剂是为了提高H2的转化率
D. 0.5 mol N2和1.5 mol H2在题给条件下充分反应,放出热量为46.2 kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应:aA(气)+bB(气) ![]() cC(气)+dD(气);△H=Q试根据图回答
cC(气)+dD(气);△H=Q试根据图回答

(1)压强P1比P2______(填大、小)
(2)体积(a+b)比(c+d)____(填大、小)
(3)温度t1℃比t2℃______(填高、低)
(4)Q值是______(填正、负)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)在化工、医药、农药等方面有广泛的应用。利用甲醛一定条件下直接脱氢可制甲醛,反应方程式:CH3OH(g)![]() HCHO(g)+H2(g) △H1
HCHO(g)+H2(g) △H1
实验测得随温度升高,平衡常数如下表所示。
温度(K) | 500 | 700 | T1 | T2 | T3 |
平衡常数 | 7.13×10-4 | 3.30×10-1 | 2.00 | 9.00 | 10.00 |
(1)甲醛分子中所有原了都达到稳定结构,甲醛的电子式为_____________。
(2) 若在恒温恒压容器中进行上述反应,可判断反应到达平衡状态的是_______________。
A.混合气体的密度不变
B.CH3OH、HCHO的物质的量浓度之比为1:1
C.H2的体积分数不再改变
D.单位时间内甲醛的生成量与氢气的消耗量相等
(3)T1时,CH3OH、HCHO、H2 起始浓度(mol·L-1)分别为1.0、0.50 、1.0,反应达到平衡时,HCHO 的体积分数___________20% (填“>”、“ =”、“ <”)。
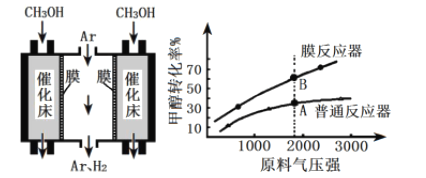
(4)工业上采用膜分离器(对氢气具有很高的选择性和透过率)催化脱氢,装置如下图。为探究转化率变化,分别在普通反应器和膜反应器中,改变原料气压强,控制相同温度,经过相同反应时间,测定甲醇转化率,实验结果如下图。
①A点:v正______v逆(填“>”、“ =”、“ <”),理由是____________;
②B点比A点转化率高的原因是_______________。
(5)体系中加入一定量氧气有利于甲醛的生成。反应体系中存在下列反应:
CH3OH(g)+1/2O2(g)![]() HCHO(g)+H2O(g) △H2
HCHO(g)+H2O(g) △H2
H2(g)+12O2(g)![]() H2O(g) △H3
H2O(g) △H3
则△H2、△H3的大小关系是△H2________△H3(填“>”、“ =”、“ <”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在0.1 mol·L-1 CH3COOH溶液中存在如下电离平衡:CH3COOH![]() CH3COO-+H+,对于该平衡,下列叙述正确的是( )
CH3COO-+H+,对于该平衡,下列叙述正确的是( )
A. 加入少量0.1 mol·L-1 HCl溶液,溶液中c(H+)不变
B. 加入水稀释时,平衡向正反应方向移动,溶液中所有离子的浓度都减小
C. 加入少量CH3COONa固体,平衡向逆反应方向移动,平衡常数变大
D. 加入少量NaOH固体,促进了醋酸的电离,溶液中![]() 变大
变大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com