
25℃时,将pH均为2的HCl与HX的溶液分别加水稀释,溶液pH随溶液体积变化的曲线如下图所示。下列说法正确的是
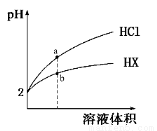
A.稀释前,c(HX)=0.01 mol/L B.稀释10倍,HX溶液的pH=3
C.a、b两点:c(X-)>c(Cl-) D.溶液的导电性:a>b
科目:高中化学 来源:2014-2015河北唐山市高一下学期开学调研考试化学试卷(解析版) 题型:选择题
用NA代表阿伏加德罗常数,下列说法正确的是
A.5.6gFe与足量氯气反应时失去的电子数为0.2NA
B.常温常压下,4.8 g O2和O3的混合气体所含原子数为0.3NA
C.0.3mol/LNa2SO4溶液中,所含Na+和SO42-总数为0.9NA
D.在反应2H2O2 2 H2O+O2↑中每生成3.2gO2转移的电子数为0.4NA
2 H2O+O2↑中每生成3.2gO2转移的电子数为0.4NA
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省唐山市高二下学期开学调研化学试卷(解析版) 题型:选择题
纳米钴(Co)是加氢反应的催化剂,500K时催化反应:CO(g)+3H2(g) CH4(g)+H2O(g) △H<0。有关说法正确的是
CH4(g)+H2O(g) △H<0。有关说法正确的是
A.纳米技术的应用,提高了催化剂的催化性能,但平衡常数不变
B.缩小容器体积,平衡向正反应方向移动CO的浓度减小
C.温度越低,越有利于CO催化加氢
D.从平衡体系中分H2O(g)能加快正反应速率
查看答案和解析>>
科目:高中化学 来源:2014-2015学年天津市河东区高三一模理综化学试卷(解析版) 题型:填空题
(14分)四种常见的短周期非金属元素在周期表中的相对位置如下所示,其中乙元素原子核外最外层电子数是其电子层数的三倍。
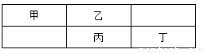
请用化学用语回答:
(1)丙在元素周期表中的位置___________________________
(2)丁单质的电子式___________________________________
(3)乙的两种常见单质分别是__________,_______________
(4)甲乙丙丁的气态氢化物水溶液显酸性的是(写化学式)________,________
(5)氢元素和乙组成的化合物中,既含有极性共价键又含有非极性共价键的是(写化学式)__________。此化合物可将碱性工业废水中CN-氧化为可溶性碳酸盐和氨,相应的离子方程式_________________
(6)电解丁的钠盐饱和溶液的离子方程式________________________________
(7)若甲的元素符号为X。已知①X2(g)+2O2(g)==X2O4(l) △H=-19.5KJ/mol ②X2H4(l)+O2(g)==X2(g)+2H2O(g) △H=-534.2KJ/mol则液态X2H4和液态的X2O4反应生成气态X2和气态H2O的热化学方程式为______________________________________________________
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省宜宾市高三第二次诊断测试化学试卷(解析版) 题型:填空题
(15分)回收利用印刷电路板上的铜制备铜的化合物,实现资源的再利用。
(1)回收利用印刷电路板上的铜制备CuCl2。
实验室模拟回收过程如下:

已知部分物质开始沉淀和沉淀完全时的pH如下表:
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)2 | 7.6 | 9.6 |
Fe(OH)3 | 2.7 | 3.7 |
Cu(OH)2 | 4.4 | 8.0 |
请回答下列问题:
①步骤III的操作名称是 。
②下列试剂中,可以作为试剂a的是 。
A.HNO3溶液 B.Fe2(SO4)3溶液 C.FeCl3溶液
③若不加试剂b,直接加入试剂c调节溶液pH,是否可行? (填“是”或“否”),理由是 。
(2)用H2O2和硫酸共同浸泡印刷电路板制备硫酸铜。
已知:2H2O2(l)=2H2O (l) +O2(g) △H1=-196kJ/mol
H2O(l)=H2(g) +1/2O2(g) △H2=+286kJ/mol
Cu(s) +H2SO4(aq)=CuSO4(aq) +H2(g) △H3=+64kJ/mol
则Cu(s) +H2O2(l) +H2SO4(aq) =CuSO4(aq) +2H2O(l) △H = 。
(3)将反应Cu+H2O2+H2SO4=CuSO4+2H2O设计成原电池,其正极电极反应式是 。
(4)若用硝酸和硫酸共同浸泡印刷电路板制备硫酸铜,假设印刷电路板中其他成分不与酸反应,欲制取3mol纯净的硫酸铜,需要0.5 mol/L的硝酸溶液的体积是 L。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省宜宾市高三第二次诊断测试化学试卷(解析版) 题型:选择题
下列物质的使用不涉及化学变化的是
A.用饱和硫酸铵溶液沉淀蛋白质
B.用生石灰干燥氨气
C.用铝制的容器盛装浓硫酸
D.用饱和碳酸钠溶液收集实验室制取的乙酸乙酯
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省广安市高三二诊理综化学试卷(解析版) 题型:选择题
设NA为阿伏加德罗常数的值。下列说法正确的是
A.1 mol[Zn(NH3)4]Cl2中含有σ键的数目为16 NA
B.电解精炼粗铜时,每转移NA电子,阳极上溶解的铜原子数必为0.5 NA
C.3.0 g淀粉和葡萄糖混合物中共含碳原子数为0.1NA
D.60 g石英晶体中含有的Si—O键数目为2NA
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省济宁市高三第一次模拟考试理综化学试卷(解析版) 题型:填空题
选做(12分)【化学一物质结构与性质】原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期,自然界中存在多种A的化合物,B原子核外电子有6种不同的运动状态,B与C可形成正四面体形分子,D的基态原子的最外能层只有一个电子,其他能层均已充满电子。
请回答下列问题:
(1)这四种元素中电负性最大的元素,其基态原子的价电子排布式为_________,第一电离能最小的元素是__________(填元素符号)。
(2)C所在主族的前四种元素分别与A形成的化合物,沸点由高到低的顺序是________(填化学式)。
(3)B元素可形成多种单质。一种晶体结构如图一所示,其原子轨道的杂化类型为________。另一种的晶胞如图二所示,若此晶胞中的棱长为356.6pm,则此晶胞的密度为_________g·cm-3(保留两位有效数字)。(已知: )
)

(4)D的醋酸盐晶体局部结构如图三,该晶体中含有的化学键是________(填选项序号)。
①极性键 ②非极性键 ③配位键 ④金属键
(5)向D的硫酸盐溶液中滴加过量氨水,观察到首先形成蓝色沉淀,继续滴加氨水,沉淀溶解,得到深蓝色的透明溶液。请写出沉淀溶解的离子方程式:_________________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东肥城市高三一模理综化学试卷(解析版) 题型:实验题
(18分)以铝灰(主要成分为Al、Al2O3,另有少量CuO、SiO2、FeO和Fe2O3杂质)为原料,可制得液体聚合氯化铝 [Alm(OH)nCl3m—n],生产的部分过程如下图所示(部分产物和操作已略去)。

(1)Al2O3与盐酸反应的离子方程式是_____________________。
(2)滤渣I是__________。滤渣2为黑色,该黑色物质的化学式是___________。
(3)向滤液2中加入NaClO溶液至不再产生红褐色沉淀,此时溶液的pH约为3.7。其中NaClO的作用是___________。该过程发生反应的离子方程式为______________。
(4)将滤液3的pH调至4.2~4.5,利用水解反应得到液体聚合氯化铝。该反应的化学方程式为_____________________。
(5)Na2S溶液呈碱性的原因是________(用离子方程式表示)。该溶液中c(Na+)=________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com