
| 实验 编号 | 实验目的 | 温度/℃ | 催化剂 质量/g | 反应物初始浓度 /10-3mol•L-1 | |
| H2 | I2 | ||||
| Ⅰ | 为以下实验作参照 | 457 | 0 | 7 | 9 |
| Ⅱ | 420 | 7 | 9 | ||
| Ⅲ | 探究催化剂对该反应速率的影响 | 10 | 7 | 9 | |

分析 (1)探究某一探究对反应速率的影响时,除了该条件不同外,其它条件必须完全相同,据此进行解答;
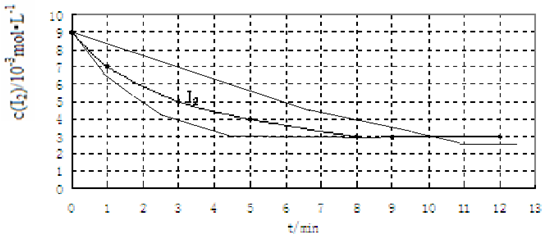
(2)①根据0~5min内碘单质的浓度变化计算平均速率ν(I2);
②根据温度、催化剂对反应速率、化学平衡的影响画出实验Ⅱ、Ⅲ中I2的物质的量浓度(c)随时间(t)变化的曲线;
③该反应为体积不变的反应,压强不影响化学平衡,所以无法利用此反应研究压强对化学平衡的影响.
解答 解:(1)Ⅰ为参照实验,实验Ⅱ与Ⅰ中只有反应温度不同,实验Ⅱ为探究温度对反应速率的影响,除温度外其他与Ⅰ相同,所以催化剂为0;实验Ⅲ探究催化剂对反应速率的影响,所以实验Ⅲ与实验Ⅰ中除了催化剂不同外,其它条件完全相同,即温度应该为457℃,
故答案为:
| 实验 编号 | 实验目的 | 温度/℃ | 催化剂 质量/g | 反应物初始浓度 /10-3mol•L-1 | |
| H2 | I2 | ||||
| Ⅰ | |||||
| Ⅱ | 探究温度对该反应速率的影响 | 0 | |||
| Ⅲ | 457 | ||||
 ,
, ;
;点评 本题考查了探究温度、催化剂对化学反应速率的影响,题目难度中等,注意明确温度、压强、催化剂等化学反应速率的因素,其中试题(2)②为难点,注意掌握正确的解决方法.


科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,33.6L氟化氢中含有氟原子的数目为1.5NA | |
| B. | 常温常压下,7.0g由乙烯与丙烯组成的混合物中含有氢原子的数目为NA | |
| C. | 1mol Al3+含有的核外电子数为3NA | |
| D. | 某密闭容器装有0.1mol N2和0.3mol H2,在一定条件下充分反应,转移电子的数目为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用托盘天平称取11.72g食盐 | |
| B. | 用100mL的量筒量取25.00mL盐酸 | |
| C. | 用pH试纸测得某稀醋酸溶液的pH为3.5 | |
| D. | 用0.2000mol•L-1HCl溶液滴定20.00mL未知浓度NaOH,用去22.40mL HCl溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 被提纯的物质 | 除杂试剂 | 分离方法 |
| A | 溴苯(溴) | 水 | 分液 |
| B | 苯(甲苯) | CCl4 | 分液 |
| C | 乙炔(硫化氢) | NaOH溶液 | 洗气 |
| D | 甲烷(乙烯) | KMnO4酸性溶液 | 洗气 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CaCl2 MgCl2 Na2O | B. | H2O Na2O ?CO2 | ||
| C. | CaCl2 ?NaOH H2SO4 | D. | NH4Cl H2O CO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com