考点:元素周期律和元素周期表的综合应用
专题:
分析:这几种元素都是短周期元素,主族元素中,元素最高正化合价与其族序数相等,最低负化合价=族序数-8,同一主族元素,原子半径随着原子序数增大而增大,同一周期元素,原子半径随着原子序数增大而减小;
根据表中数据知,X、T属于第IA族元素,T原子半径最大,则T为Na,X原子半径不最小,则X为Li元素;
Y位于第VA族、Z位于第IIIA族、W位于第IVA族、M和P位于第VIA族、K位于第VIIA族、R位于第IIA族,
P原子半径大于M,则P为S元素、M为O元素;
K还含有正化合价,则K为Cl元素;
W原子半径稍微大于M,则W为C元素;
Y位于第VA族且原子半径大于W,所以Y为P元素;
Z原子半径大于Y且位于第IIIA族,则Z为Al元素;
R原子半径大于Z,则R是Mg元素;
(1)通过以上分析知,Y是磷元素;R是Mg元素,其原子核外有3个电子层、最外层电子数是2,主族元素中电子层数与其周期数相等、最外层电子数与其族序数相等;
(2)T是Na元素,其离子核外有2个电子层、最外层有8个电子,离子结构示意图为
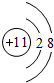
;W为C元素,C原子核外有2个电子层、最外层有4个电子,原子结构示意图为
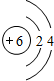
,
故答案为:
;
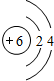
;
(3)T是Na元素、P是S元素,Na和S元素形成的离子化合物硫化钠,其电子式为
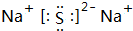
,故答案为:
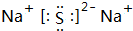
;
(4)离子的电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小;
(5)①W是C、P的最高价氧化物的水化物是硫酸,浓硫酸和C在加热条件下发生氧化还原反应生成二氧化硫、二氧化碳和水;
②Mg单质与CO
2在点燃条件下反应生成C和MgO.
解答:
解:这几种元素都是短周期元素,主族元素中,元素最高正化合价与其族序数相等,最低负化合价=族序数-8,同一主族元素,原子半径随着原子序数增大而增大,同一周期元素,原子半径随着原子序数增大而减小;
根据表中数据知,X、T属于第IA族元素,T原子半径最大,则T为Na,X原子半径不最小,则X为Li元素;
Y位于第VA族、Z位于第IIIA族、W位于第IVA族、M和P位于第VIA族、K位于第VIIA族、R位于第IIA族,
P原子半径大于M,则P为S元素、M为O元素;
K还含有正化合价,则K为Cl元素;
W原子半径稍微大于M,则W为C元素;
Y位于第VA族且原子半径大于W,所以Y为P元素;
Z原子半径大于Y且位于第IIIA族,则Z为Al元素;
R原子半径大于Z,则R是Mg元素;
(1)通过以上分析知,Y是磷元素;R是Mg元素,其原子核外有3个电子层、最外层电子数是2,主族元素中电子层数与其周期数相等、最外层电子数与其族序数相等,所以Mg元素位于第三周期第IIA族,
故答案为:磷;第三周期第IIA族;
(2)T是Na元素,其离子核外有2个电子层、最外层有8个电子;W为C元素,C原子核外有2个电子层、最外层有4个电子;
(3)T是Na元素、P是S元素,Na和S元素形成的离子化合物硫化钠;
(4)离子的电子层数越多其离子半径越大,电子层结构相同的离子,离子半径随着原子序数增大而减小,所以离子半径大小顺序是S
2->Cl
->O
2->Na
+>Al
3+,故答案为:S
2->Cl
->O
2->Na
+>Al
3+;
(5)①W是C、P的最高价氧化物的水化物是硫酸,浓硫酸和C在加热条件下发生氧化还原反应生成二氧化硫、二氧化碳和水,反应方程式为C+2H
2SO
4(浓)
CO
2↑+2SO
2↑+2H
2O,故答案为:C+2H
2SO
4(浓)
CO
2↑+2SO
2↑+2H
2O;
②Mg单质与CO
2在点燃条件下反应生成C和MgO,反应方程式为2Mg+CO
2C+2MgO,故答案为:2Mg+CO
2C+2MgO.
点评:本题考查元素周期表和元素周期律的综合应用,明确元素化合价、原子半径变化规律是解本题关键,知道离子半径大小比较方法,注意镁能在二氧化碳中燃烧,为易错点.

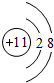 ;W为C元素,C原子核外有2个电子层、最外层有4个电子,原子结构示意图为
;W为C元素,C原子核外有2个电子层、最外层有4个电子,原子结构示意图为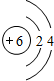 ,
,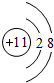 ;
;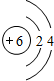 ;
;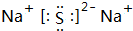 ,故答案为:
,故答案为: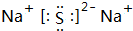 ;
;

 金钥匙试卷系列答案
金钥匙试卷系列答案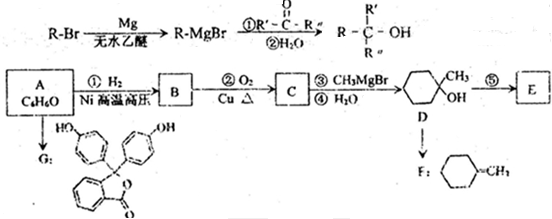
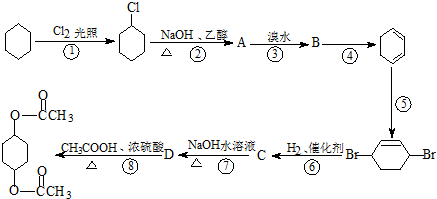
 的合成路线流程图(无机试剂任选),方框内写有机物结构简式,在“→”上或下方写反应所需条件或试剂.
的合成路线流程图(无机试剂任选),方框内写有机物结构简式,在“→”上或下方写反应所需条件或试剂.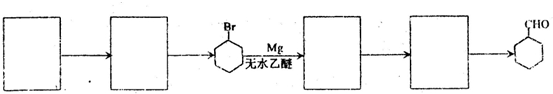
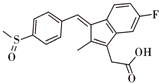 )广发适用于各种关节炎以及各种原因引起的疼痛的临床治疗,它的一种合成路线如下:
)广发适用于各种关节炎以及各种原因引起的疼痛的临床治疗,它的一种合成路线如下:
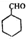
 备的合成路线.
备的合成路线.