
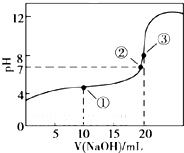
 常温下,用0.1mol/L溶液滴定20mL 0.1mol/L CH3COOH溶液的滴定曲线如图.下列说法正确的是( )
常温下,用0.1mol/L溶液滴定20mL 0.1mol/L CH3COOH溶液的滴定曲线如图.下列说法正确的是( )| A、滴定过程中不可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |
| B、点①所示溶液中c(CH3COO-)>c(Na+)>c(CH3COOH)>c(H+)>c(OH-) |
| C、点②所示溶液中c(CH3COOH)>c(Na+)=c(CH3COO-)>c(H+)=c(OH-) |
| D、点③所示溶液中c(Na+)+c(H+)=c(CH3COOH)+c(OH-) |


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 羧基(-COOH) | 巯基(-SH) | H2O | |
| pKa | 3.7 | 9.8 | 16 |

| A、分子式为C9H15NO3S |
| B、具有较强的还原性 |
| C、易跟H2发生加成反应 |
| D、1mol最多跟含3molNaOH的溶液发生反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Cu与稀盐酸 |
| B、NaHCO3与NaOH溶液 |
| C、CaCO3与稀硫酸 |
| D、NH4HCO3与稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 序号 | 碳酸钙 状态 | C(HCl)/ mol?L-1 | 溶液温度/℃ | 碳酸钙消失 时间/s | |
| 反应前 | 反应后 | ||||
| 1 | 块状 | 0.5 | 20 | 39 | 400 |
| 2 | 粉末 | 0.5 | 20 | 40 | 60 |
| 3 | 块状 | 0.6 | 20 | 41 | 280 |
| 4 | 粉末 | 0.8 | 20 | 40 | 30 |
| 5 | 块状 | 1.0 | 20 | 40 | 120 |
| 6 | 块状 | 1.0 | 30 | 50 | 40 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 分子,下列说法正确的是( )
分子,下列说法正确的是( )| A、处于同一直线的碳原子共有9个 |
| B、处于同一平面的碳原子至少有9个 |
| C、处于同一直线的碳原子最多有10个 |
| D、处于同一平面的原子最多有21个 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、加入少量金属Na,平衡①左移,平衡②右移,溶液中c(HSO3-)增大 | ||||||||
B、加入少量Na2SO3固体,则c(H+)+c(Na+)=c(HSO3-)+c(OH-)+
| ||||||||
C、加入少量NaOH溶液,
| ||||||||
| D、加入NaOH溶液至中性,则c(Na+)=c(SO32-)+c(HSO3-)+c(H2SO3) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com