
【题目】下列反应中,水作还原剂的是
A. Mg+2H2O![]() Mg(OH)2+H2↑
Mg(OH)2+H2↑
B. 2F2+2H2O═4HF+O2
C. Cl2+H2O![]() HCl+HClO
HCl+HClO
D. 2Na2O2+2H2O═4NaOH+O2↑
【答案】B
【解析】
水作还原剂说明水中氧元素的化合价升高,据此解答。
A.在反应Mg+2H2O![]() Mg(OH)2+H2↑中氢元素的化合价降低,水是氧化剂,A不选;
Mg(OH)2+H2↑中氢元素的化合价降低,水是氧化剂,A不选;
B.在反应2F2+2H2O=4HF+O2中F元素的化合价从0价降低到—1价,得到1个电子,单质氟是氧化剂。水中氧元素的化合价从—2价升高到0价,失去2个电子,水是还原剂,B选;
C.在反应Cl2+H2O![]() HCl+HClO中氯元素的化合价既升高,也降低,其余元素的化合价不变,因此氯气既是氧化剂,也是还原剂,水不是氧化剂也不是还原剂,C不选;
HCl+HClO中氯元素的化合价既升高,也降低,其余元素的化合价不变,因此氯气既是氧化剂,也是还原剂,水不是氧化剂也不是还原剂,C不选;
D.在反应2Na2O2+2H2O=4NaOH+O2↑中过氧化钠中氧元素的化合价部分升高部分降低,过氧化钠既是氧化剂也是还原剂,水不是氧化剂也不是还原剂,D不选;
答案选B。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】元素铬(Cr)在溶液中主要以Cr3+(蓝紫色)、Cr(OH) 4— (绿色)、Cr2O72—(橙红色)、CrO42— (黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:
(1)Cr3+和Al3+的化学性质相似,在Cr2(SO4)3溶液中逐滴加入NaOH溶液直至过量,可观察到的现象是_______,离子方程式____________________________。
(2)CrO42—和Cr2O72—在溶液中可相互转化。室温下,初始浓度为1.0mol·L1的Na2CrO4溶液中c(Cr2O![]() )随c(H+)的变化如图所示。
)随c(H+)的变化如图所示。
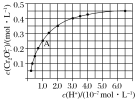
①当溶液酸性增强的时候,溶液颜色变化情况为:_________________。
②由图可知,溶液酸性增大,CrO42—的平衡转化率_________(填“增大”“减小”或“不变”)。根据A点数据,计算出该转化反应的平衡常数为__________。
③升高温度,溶液中CrO42—的平衡转化率减小,则该反应的ΔH_____0(填“大于”“小于”或“等于”)。(3)在化学分析中采用K2CrO4为指示剂,以AgNO3标准溶液滴定溶液中Cl-,利用Ag+与CrO42—生成砖红色沉淀,指示到达滴定终点。当溶液中Cl-恰好沉淀完全(浓度等于1.0×105molL1)时,溶液中c(Ag+)___molL1,此时溶液中c(CrO42—)等于_____molL1 (已知Ag2CrO4、AgCl的Ksp分别为2.0×1012和2.0×1010)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列反应现象,回答问题:
(1)向氯化铜溶液中滴加氢氧化钠溶液,其现象是________________________________,离子反应方程式是________________________________。
(2)向碳酸氢钠溶液中滴加稀硫酸,其现象是________________________________________,离子反应方程式是____________________________________。
(3)稀硝酸与氢氧化钾溶液混合,其现象是_________________________________________,离子反应方程式是______________________________________。
(4)上述三个反应均属于______________反应(填基本反应类型),反应发生的条件的不同点是第一个生成________________,第二个生成______________,第三个生成______________;相同点是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于物质的量浓度表述正确的是( )
A. 98%的H2SO4物质的量浓度为18.4mol/L ,则49%的H2SO4物质的量浓度为9.2mol/L
B. 当2L水吸收44.8L氨气(标况)时所得氨水的浓度不是1molL-1,只有当44.8L(标况)氨气溶于水制得2L氨水时,其浓度才是1molL-1
C. 只含K2SO4和NaCl的混合水溶液中,如果Na+和SO42-的物质的量相等,则K+和Cl-的物质的量浓度一定相同
D. 50mL 1mol/L的AlCl3溶液中的Cl—浓度与50ml 3mol/L的BaCl2溶液Cl—浓度相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯净干燥的氯气与熔融金属锡反应可制备 SnCl4,某化学小组的同学设计了如下实验装置进行制备。

已知:①金属锡熔点为 231℃,化学活泼性与铁相似;②SnCl4 的沸点为 114℃;③SnCl4 易与水反应。
请根据上图装置回答:
(1)装置Ⅳ中发生反应的化学方程式为__________________________。
(2)试管II中的试剂是___________________,装置 V 的作用是______________。
(3)裝置Ⅵ最好选用下列装置中的______________________(填标号)。

(4)实验结束后,欲回收利用装置Ⅰ中未反应完的 MnO2,需要的分离方法___________。
(5)为了顺利完成实验,点燃酒精灯的正确操作是___________________(填字母)。
A.先点燃 I 处酒精灯,后点燃Ⅳ处酒精灯
B.先点燃Ⅳ处酒精灯,后点燃 I 处酒精灯
C.同时点燃 I、Ⅳ两处酒精灯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃的相对分子质量为56。
(1)该烃的分子式为_________________________。
(2)若能使酸性KMnO4溶液褪色,则可能的结构简式为__________________________。
(3)上述(2)中的混合物与足量H2反应后,所得产物共有__________种。
(4)上述(2)中的混合物若与足量HBr反应后,所得产物共有______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碱式磷酸钙[Ca10(PO4)6(OH)2],工业上叫羟基磷灰石或羟磷灰石,是人的牙齿中比较坚硬的物质,在水中有微弱的溶解,这是牙齿损坏的主要原因。氟磷酸钙也称氟磷灰石,它的化学式为Ca10(PO4)6F2,是牙表面牙釉的主要成分。
回答下列问题:
(1)基态钙原子的价层电子排布式为____________。基态磷原子的未成对电子数为______________。
(2)碱式磷酸钙中含氧酸根离子的中心原子杂化类型是______________________,含氧酸根离子的空间构型为______________;
(3)氢氟酸溶液中存在:2HF![]() H2F2,H2F2为一元酸,则氢氟酸溶液中含氟阴离子是______________(填离子符号)。氢氟酸中存在H2F2的原因是______________________________________________。与H2F+互为等电子体的分子是________________(写出一个即可)。
H2F2,H2F2为一元酸,则氢氟酸溶液中含氟阴离子是______________(填离子符号)。氢氟酸中存在H2F2的原因是______________________________________________。与H2F+互为等电子体的分子是________________(写出一个即可)。
(4)O、F、P的电负性由小到大的顺序为______________。
(5)NH3和PH3的构型相似,NH3的键角略大于PH3,从原子结构角度解释其原因:________________。
(6)CaF2晶胞如图所示。位于体内的粒子的配位数为______________。

已知:氟化钙晶体密度为ρg·cm-3,NA代表阿伏加德罗常数的值。
氟化钙晶体中Ca2+和F-之间最近核间距(d)为______________pm(只要求列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,0.1 mol·L-1 NaOH溶液分别滴定100 mL 0.1 mol·L-1 HA、HB两种酸溶液。pH随NaOH溶液体积如下图所示,下列判断错误的是
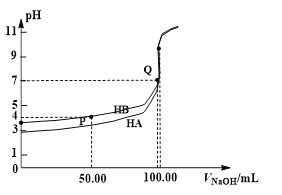
A. 电离常数:Ka(HA) > Ka(HB)
B. Ka(HB)≈10-4
C. pH=7时,c(A—)=c(B—)
D. 中和分数达100%时,HA溶液中存在![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的转化:
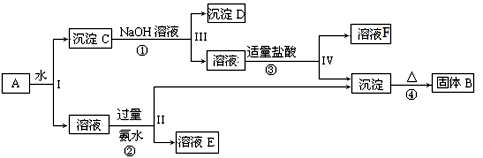
据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是______。
(2)根据上图反应关系,写出下列B、F所含物质成分的化学式:B______;F_____。
(3)写出过程反应①的离子方程式_________________,固体B所含对应的金属其单质与磁性氧化铁在高温下反应的化学方程式__________________________。
(4)写出③中盐酸过量时的离子反应方程式_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com