
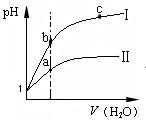
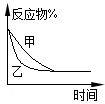
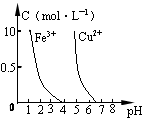
| A.图1表示同温度下,pH=1的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强 |
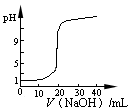
| B.图2表示0.1000 mol·L-1CH3COOH溶液滴定20.00mL0.1000 mol·L-1NaOH溶液所得到的滴定曲线 |
C.图3表示压强对可逆反应2A(g)+2B(g) 3C(g)+D(s)的影响,乙的压强比甲的压强大 3C(g)+D(s)的影响,乙的压强比甲的压强大 |
| D.据图4,若除去CuSO4溶液中的Fe3+可向溶液中加入适量CuO至pH在4左右 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.CaCO3(s)=CaO(s)+CO2(g)室温下不能自发进行,说明该反应的△H<0 |
| B.镀锌铁制品镀层受损后,铁制品比受损前更容易生锈 |
| C.生铁中含有碳,抗腐蚀能力比纯铁强 |
| D.Zn具有还原性和导电性,可用作碱性锌锰干电池的负极材料 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2AB(g)达到平衡的标志是( )
2AB(g)达到平衡的标志是( )| A.单位时间生成nmol的A2同时生成nmol的AB |
| B.容器内的总压强不随时间变化 |
| C.单位时间内生成2nmol的AB同时生成nmol的B2 |
| D.单位时间内生成nmol的A2同时生成nmol的B2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2Z反应影响的示意图。图中横坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
2Z反应影响的示意图。图中横坐标表示平衡混合气体中Z的体积分数。下列叙述正确的是
| A.上述可逆反应的正反应为放热反应 |
| B.X、Y、Z均为气态 |
| C.X和Y中只有一种为气态,Z为气态 |
| D.上述反应的逆反应的ΔH>0 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.放热的自发过程可能是熵减小的过程,吸热的自发过程一定为熵增加的过程 |
| B.由能量判据(以焓变为基础)和熵判据组合成的复合判据,将更适合于所有的过程 |
| C.在室温下碳酸钙的分解反应不能自发进行,但同样是这个吸热反应在较高温度(1200 K)下则能自发进行 |
| D.放热过程(ΔH<0)或熵增加(ΔS>0)的过程一定是自发的 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若ΔH<0,ΔS>0,任何温度下都能自发进行 |
| B.若ΔH>0,ΔS<0,任何温度下都不能自发进行 |
| C.若ΔH>0,ΔS>0,低温时可自发进行 |
| D.若ΔH<0,ΔS<0,低温时可自发进行 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题
 C(g)
C(g) +2D(g);ΔH<0
+2D(g);ΔH<0
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.凡是放热反应都是自发反应 |
| B.凡是熵增大的反应都是自发反应 |
| C.不自发的化学反应就不能进行 |
| D.要判断反应进行的方向,必须综合考虑体系的焓变和熵变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com