
| A. | WO3 | B. | Fe3O4 | C. | MnO2 | D. | V2O5 |
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:选择题
| A. | Na2O2与水反应:2O22-+2H2O═4OH-+O2↑ | |
| B. | 小苏打与烧碱溶液反应 HCO3-+OH-═CO2↑+H2O | |
| C. | Ca(HCO3)2与过量的NaOH溶液反应:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| D. | 用FeCl3溶液腐蚀铜电路板:Fe3++Cu═Fe2++Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Li是负极,电极反应为Li-e-═Li+ | |
| B. | 锂电池属于一次性电池 | |
| C. | MnO2是正极,电极反应为MnO2+e-═MnO${\;}_{2}^{-}$ | |
| D. | 锂电池是一种环保型电池 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
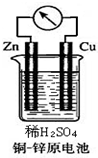 如图所示的铜-锌原电池中,理论上应观察到的现象是:
如图所示的铜-锌原电池中,理论上应观察到的现象是:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
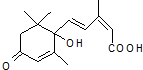 农艺师对盆栽施用S-诱抗素剂(分子结构如图),可以使鲜花按时盛开.下列说法不正确的是( )
农艺师对盆栽施用S-诱抗素剂(分子结构如图),可以使鲜花按时盛开.下列说法不正确的是( )| A. | S-诱抗素的分子式为C15 H20 O4 | |
| B. | S-诱抗素既能发生加聚反应,又能发生缩聚反应 | |
| C. | 1 mol S-诱抗素最多能和含1 mol NaOH的水溶液发生反应 | |
| D. | S-诱抗素既可以与FeCl3溶液发生显色反应,又可以使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
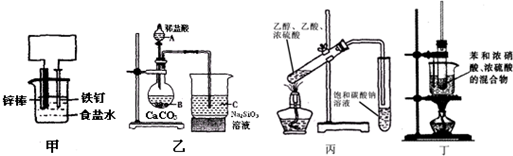
| A. | 装置甲:防止铁钉生锈 | B. | 装置乙:验证C的非金属性强于Si | ||
| C. | 装置丙:实验室制取乙酸乙酯 | D. | 装置丁:实验室制备硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 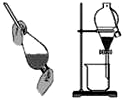 如图装置可用于分离甲苯和液溴的混合物 | |
| B. | 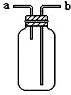 如图装置可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体 | |
| C. | 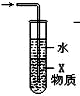 如图装置中X若为CCl4,可用于吸收NH3或HCl,并防止倒吸 | |
| D. | 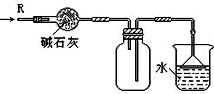 如图装置可用于干燥、收集NH3,并吸收多余的NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
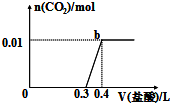 向混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列对溶液中溶质组成成分判断正确的是( )
向混合溶液中滴加0.1mol/L稀盐酸,CO2的生成量与加入盐酸的体积(V)的关系如图所示.下列对溶液中溶质组成成分判断正确的是( )| A. | 原溶液中溶质为Na2CO3和NaHCO3 | B. | 原溶液中溶质为 NaOH和Na2CO3 | ||
| C. | 原溶液中溶质为Na2CO3 | D. | 原溶液中溶质为NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现在,德国的许多餐馆自身就具备油脂分离技术,将”地沟油”分离出来的废油将被制成生物柴油.已知生物柴油是高级脂肪酸甲酯,可由油脂与甲醇通过酯交换反应生成新酯和新醇得到,酯交换过程可以表示为:
现在,德国的许多餐馆自身就具备油脂分离技术,将”地沟油”分离出来的废油将被制成生物柴油.已知生物柴油是高级脂肪酸甲酯,可由油脂与甲醇通过酯交换反应生成新酯和新醇得到,酯交换过程可以表示为: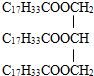 .经上述实验后得到油酸甲酯15.40g,则该实验中生物柴油(全以油酸甲酯计量)的产率为57.8%%.
.经上述实验后得到油酸甲酯15.40g,则该实验中生物柴油(全以油酸甲酯计量)的产率为57.8%%.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com