


科目:高中化学 来源: 题型:
| A、Na、Mg、Al原子的最外层电子数依次减小 |
| B、C、N、O的原子半径依次减小 |
| C、Si、P、S元素的最高价依次降低 |
| D、Li、Na、K的金属性依次减弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:

| A、实验室收集氨气采用图1所示装置 |
| B、实验室中做氯气与钠的反应实验时采用图2所示装置 |
| C、实验室中用玻璃棒分别蘸取浓盐酸和浓氨水做氨气与酸反应生成铵盐的实验 |
| D、实验室中采用图3所示装置进行铜与稀硝酸的反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验 编号 | 淀粉溶液的 用量/mL | 温度/℃ | 酸 | 加酸后溶液中 c(H+)/mol?L-1 | 蓝色褪去所需的 时间/min |
| 1 | 30 | 50 | 盐酸 | 0.01 | 40 |
| 2 | 30 | T1 | 盐酸 | 0.05 | 20 |
| 3 | 30 | T2 | 盐酸 | 0.10 | 8 |
| 4 | 30 | T3 | 硫酸 | 0.05 | 12 |
| 5 | 30 | T4 | 醋酸 | a | 15 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 氮元素可以形成多种氢化物,如NH3、N2H4等.
氮元素可以形成多种氢化物,如NH3、N2H4等.| T/℃ | 165 | 175 | 185 | 195 |
| K | 111.9 | 74.1 | 50.6 | 34.8 |
| n(NH3) |
| n(CO2) |
c(N
| ||
| c(NH3?H2O)?c(H +) |
查看答案和解析>>
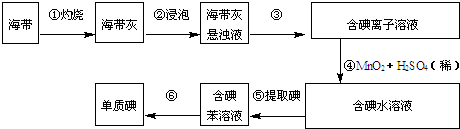
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ⑤ | ⑥ | ||||||
| 3 | ① | ③ | ④ | ⑦ | ⑨ | |||
| 4 | ② | ⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、烃分子中的H原子被-OH取代后的衍生物都是醇 |
| B、乙醇分子中的氢均可被金属钠置换 |
| C、甲醇不能发生消去反应而生成烯烃 |
| D、某一元醇在浓硫酸的作用下加热到170℃可以生成丙烯,该一元醇一定是1-丙醇 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com