
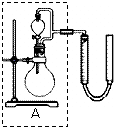
 过氧化氢对环境友好,性质多样,有很重要的研究和应用价值.
过氧化氢对环境友好,性质多样,有很重要的研究和应用价值.| 序号 | 条件 | 现象 | 结论 | |
| 温度/℃ | 催化剂 | |||
| 1 | 40 | FeCl3溶液 | ||
| 2 | 20 | FeCl3溶液 | ||
| 3 | 20 | MnO2 | ||
| 4 | 20 | 无 | ||
分析 (1)①通过比较表格中的数据的异同点进行解答:实验1、2只有温度不同;实验2、3催化剂不同;实验中可以表明该反应速率差异的现象是产生气泡的快慢;
②根据分液漏斗的结构与功能进行解答;
(2)①Fe2+能被H2O2氧化为Fe3+在碱性溶液中会生成红褐色沉淀Fe(OH)3;
②根据过氧化钠与水反应的方程式以及高锰酸钾与过氧化氢反应,利用物质的量相关公式进行计算.
解答 解:(1)①实验1、2只有温度不同,所以研究的是温度对反应速率的影响;实验2、3温度是相同的,而催化剂不同,所以研究的是不同催化剂对反应速率的影响.反应速率快,产生的气体多,气泡就多而快,反应速率慢,产生的气体少,气泡就少而慢,
故答案为:温度;比较FeCl3溶液和MnO2作为催化剂对H2O2分解反应速率影响的差异;产生气泡的快慢;
②过氧化氢在FeCl3溶液催化的作用下分解,反应过于剧烈,可控制滴加的量控制反应的速率,分液漏斗带有玻璃活塞,旋转分液漏斗的活塞,控制滴加H2O2溶液的速率,
故答案为:旋转分液漏斗的活塞,控制滴加H2O2溶液的速率;
(2)①Fe2+能被H2O2氧化为Fe3+在碱性溶液中会生成红褐色沉淀2Fe(OH)3所以反应离子方程式为2Fe2++4OH-+H2O2=2Fe(OH)3↓;
故答案为:2Fe2++4OH-+H2O2=2Fe(OH)3↓;
②44.8mL O2(已折算为标准状况),为$\frac{0.448L}{22.4L/mol}$=0.02mol,同样的计算方法得到56mLO2(已折算为标准状况),为0.0025mol,根据2Na2O2+2H2O═4NaOH+O2↑知与水反应生成氧气的过氧化钠,
2Na2O2 +2H2O═4NaOH+O2↑
0.04mol 0.02mol
滴入烧瓶内再加入过量KMnO4酸性溶液反应,过氧根被氧化成了氧气,根据5H2O2+2MnO4 -+6H+═2Mn 2++5O2↑+8H2O知与KMnO4酸性溶液反应生成氧气的过氧化钠,
5H2O2+2MnO4 -+6H+═2Mn 2++5O2↑+8H2O
0.0025mol 0.0025mol
某同学取4gNa2O2样品与过量水反应,待反应完全终止时,得100mL溶液X,取25mL X,实验,所以总的过氧化钠为:(0.04+0.0025×4)mol=0.05mol,则此样品中Na2O2的质量分数$\frac{0.05mol×78g/mol}{4g}$×100%=97.5%,
故答案为:97.5%.
点评 本题主要考查了影响化学反应的因素,解答这类题时注意影响化学反应的因素与图表中数据对比的关系,利用相关的化学反应原理进行分析解答,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | A>B>C>D | B. | D>B>A>C | C. | B>A>C>D | D. | C>A>B>D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | “84”消毒液的水溶液中:Fe2+、Cl-、H+、Na+ | |
| B. | 加入KSCN显红色的溶液:K+、NH4+、Cl-、S2- | |
| C. | 无色溶液中:K+、CH3COO-、HCO3-、MnO4- | |
| D. | pH=2的溶液中:NH4+、Na+、Cl-、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸分子中含有羧基,可与Na2CO3溶液反应生成CO2 | |
| B. | 淀粉和纤维素都属于高分子化合物 | |
| C. | 苯不能使酸性高锰酸钾褪色 | |
| D. | 苯分子中不存在碳碳双键所以不能发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  图表示KNO3的溶解度曲线,图中a点所示的溶液是80℃时KNO3的不饱和溶液 | |
| B. |  图表示某放热反应分别在有、无催化剂的情况下反应过程中的能量变化 | |
| C. |  图表示0.1000mol•L-1NaOH溶液滴定20.00mL0.1000mol•L-1醋酸溶液得到的滴定曲线 | |
| D. |  图是亚硫酸氢钠粉末投入稀硝酸溶液中有关图象 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 热化学方程式 | 结 论 | |
| A. | 2H2(g)+O2(g)═2H2O(g)△H=-483.6 kJ/mol | 氢气的燃烧热△H=-483.6 kJ/mol |
| B. | NaOH(aq)+HCl(aq)═NaCl(aq)+H2O(l) △H=-57.3 kJ/mol | 含40.0g NaOH的稀溶液与稀醋酸完全中和,放出的热量小于57.3kJ |
| C. | 2C(s)+2O2(g)═2CO2(g)△H=-a kJ/mol 2C(s)+O2(g)═2CO(g)△H=-b kJ/mol | b>a |
| D. | C (石墨,s)═C (金刚石,s)△H=+1.5 kJ/mol | 金刚石比石墨稳定 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
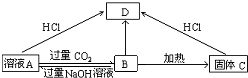
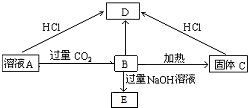
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
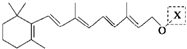
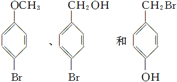
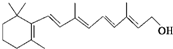 )和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.
)和C.经元素分析及相对分子质量测定,确定C的分子式为C7H6O3,C遇FeCl3水溶液显紫色,与NaHCO3溶液反应有CO2产生.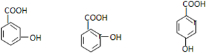 .
.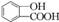 .
.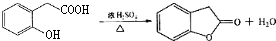 .
. .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com