
 研究NOx、SO2、CO等大气污染气体的处理具有重要意义.
研究NOx、SO2、CO等大气污染气体的处理具有重要意义.分析 (1)已知1molCO(g)与适量的SO2(g)反应生成S(s)和CO2(g)时,放出135kJ的热量,书写热化学方程式时注明物质的聚集状态与反应热;
(3)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574KJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
若1mol CH4还原NO2至N2整个过程中放出的热量为867KJ,(①+②)×$\frac{1}{2}$可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867KJ•mol-1;
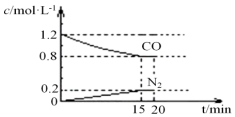
(3)①根据v=$\frac{△c}{△t}$计算v(CO),再利用速率之比等于化学计量数之比计算v(CO2),运用三行式求平衡时各组分的浓度,然后根据平衡常数等于平衡时生成物的浓度幂之积比反应物浓度幂之积,来求平衡常数;
②a.升高温度平衡逆向移动,导致NO浓度增加; b.增加CO的量,平衡正向移动,导致NO浓度下降; c.降低温度,平衡正向移动,导致NO浓度下降,d.扩大容积平衡逆向移动,但导致NO浓度下降;
(4)常温下,0.1mol•L-1NaHSO3溶液的pH小于7,说明HSO3-电离程度大于水解程度.
解答 解:(1)已知1molCO(g)与适量的SO2(g)反应生成S(s)和CO2(g)时,放出135kJ的热量,因此反应的热化学方程式为:CO(g)+$\frac{1}{2}$SO2(g)=$\frac{1}{2}$S(s)+CO2(g)△H=-135kJ/mol,故答案为:CO(g)+$\frac{1}{2}$SO2(g)=$\frac{1}{2}$S(s)+CO2(g)△H=-135kJ/mol;
(2)已知:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)△H1=-574KJ•mol-1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)△H2
若1mol CH4还原NO2至N2整个过程中放出的热量为867KJ,(①+②)×$\frac{1}{2}$可得:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867KJ•mol-1,则(-574KJ•mol-1+△H2)×$\frac{1}{2}$=-867KJ•mol-1,
解得△H2=-1160KJ/mol,
故答案为:-1160KJ/mol;
(3)①v(CO)=$\frac{△c}{△t}$=$\frac{(1.2-0.8)mol/L}{15min}$=0.027 mol?L-1?min-1;所以v(CO2)=v(CO)=0.027 mol?L-1?min-1;
2NO(g)+2CO(g)?N2(g)+2CO2(g),
初起:1 1.2 0 0
变化:0.4 0.4 0.4 0.4
平衡:0.6 0.8 0.4 0.4
所以K=$\frac{0.{4}^{2}×0.4}{0.{6}^{2}×0.{8}^{2}}$=0.14,故答案为:0.027 mol?L-1?min-1; 0.14;
②a.升高温度平衡逆向移动,导致NO浓度增加,故符合; b.增加CO的量,平衡正向移动,导致NO浓度下降,故不符合; c.降低温度,平衡正向移动,导致NO浓度下降,故不符合; d.扩大容积平衡逆向移动,但导致NO浓度下降,故不符合;故选:a;
(4)已知NaHSO3中的HSO3-既能电离又能水解:HSO3-?H++SO32-电离显酸性,HSO3-+H2O?H2SO3 +OH- 水解显碱性;常温下,0.1mol•L-1NaHSO3溶液的pH小于7,
说明电离大于水解,故:c(SO32-)>c(H2SO3),故答案为:<.
点评 本题考查了盖斯定律,平衡移动原理理解应用,化学平衡常数,盐类水解分析应用,掌握基础是关键,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | Cu+4HNO3(浓)═Cu(NO3)2+2NO2↑+2H2O | B. | Cu+2H2SO4(浓)$\frac{\underline{\;△\;}}{\;}$CuSO4+SO2↑+2H2O | ||
| C. | 3Cu+8HNO3(稀)═3Cu(NO3)2+2NO↑+4H2O | D. | 2KClO3$\frac{\underline{\;MnO_{2}\;}}{△}$2KCl+3O2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 新制氯水盛放在棕色试剂瓶中,存放于低温避光的地方 | |
| B. | 液溴易挥发,盛放在用水液封、用橡皮胶塞密封的棕色试剂瓶中 | |
| C. | 碘易升华,盛放在棕色试剂瓶中 | |
| D. | 浓盐酸易挥发,盛装在无色密封的细口玻璃试剂瓶中 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 热稳定性:Na2CO3>NaHCO3 | |
| B. | 相同温度时的水溶性:Na2CO3<NaHCO3 | |
| C. | 等物质的量浓度的溶液的碱性:Na2CO3<NaHCO3 | |
| D. | 与同浓度的盐酸反应的剧烈程度:Na2CO3>NaHCO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 反应类型 | 反应条件 |
| A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
| B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
| C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
| D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba2+、Fe2+、Cl-、NO3- | B. | CO32-、SO42-、Na+、K+ | ||
| C. | Cl-、MnO4-、OH-、K+ | D. | Mg2+、SO42-、NO3-、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com