
| A. | H2与D2、T2互为同位素 | |
| B. | 氯化钠溶液和氢氧化铁胶体可以用过滤的方法分离 | |
| C. | NH3溶于水可以导电,但不是电解质 | |
| D. | SO2、NO2均属于酸性氧化物 |
分析 A.质子数相同,中子数不同的同一元素的原子互称同位素;
B.胶体和溶液都能透过滤纸;
C.NH3本身不能电离出离子,溶液导电是NH3和水反应生成的NH3•H2O电离的原因;
D.酸性氧化物可与碱反应,且只生成盐和水,如与水反应,酸性氧化物只生成酸.
解答 解:A.H2、D2、T2是单质,不是原子,不为同位素,故A错误;
B.胶体和溶液都能透过滤纸,所以不能用过滤的方法分离氯化钠溶液和氢氧化铁胶体,故B错误;
C.NH3和水反应生成NH3•H2O,一水合氨电离出阴、阳离子而使其溶液导电,电离出阴、阳离子的物质是NH3•H2O而不是NH3,所以NH3是非电解质,故C正确;
D.SO2可与碱反应生成盐和水,是酸性氧化物,NO2与水反应生成硝酸、NO和水,不是酸性氧化物,故D错误;
故选C.
点评 本题主要考查同位素、电解质、非电解质、酸性氧化物、胶体的性质等概念,难度不大,注意这几个概念的区别.


科目:高中化学 来源: 题型:解答题
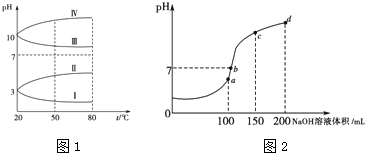
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑦⑨ | B. | ②④⑥⑧⑩ | C. | ②⑦⑧⑩ | D. | ②⑤⑧⑩ |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河南省高二上第一次月考化学卷(解析版) 题型:选择题
下列变化中,属于吸热反应的是( )
①液态水的 汽化 ②将胆矾加热变为白色粉末
汽化 ②将胆矾加热变为白色粉末
③浓硫酸稀释 ④KCl03分解制氧气
⑤生石灰跟水反应生成熟石灰
⑥CaCO3高温分解⑦CO2+C 2CO
2CO
⑧Ba(OH)2·8H2O与固体NH4Cl混合
⑨C(s)+H2O(g) CO(g)+H2(g)⑩Al与盐酸反应
CO(g)+H2(g)⑩Al与盐酸反应
A. ②③④⑤⑥⑦⑧⑨ B.②④⑥⑦⑧⑨ C.②④⑥⑧ D.②③④⑧⑨
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
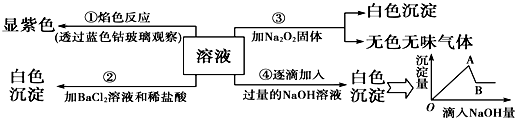
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 131I是一种新发现的元素 | |
| B. | 我们平常食用的加碘盐就是含有碘单质的食盐 | |
| C. | 卤素F、Cl、Br、I中,I的电负性和第一电离能都最小 | |
| D. | 碘单质易升华是由于碘原子半径大,共价键键能小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
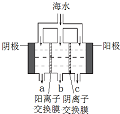 海洋是丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用.
海洋是丰富的资源宝库,通过海水的综合利用可获得许多物质供人类使用.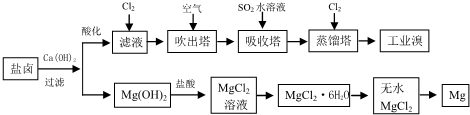
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KOH溶液与AlCl3溶液 | B. | NaAlO2溶液与盐酸 | ||
| C. | NaHCO3溶液与盐酸 | D. | Na2CO3溶液与盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
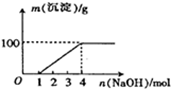
| A. | Mg2+、H+、NO3- | B. | Mg2+、Fe3+、H+、NO3- | ||
| C. | Fe3+、H+、NO3- | D. | Cu2+、H+、NO3- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com