
| R | T | |
| X | Y | Z |
| A. | R位于元素周期表中第二周期第ⅣA族 | |
| B. | 原子半径:X<R<T | |
| C. | 最简单气态氢化物稳定性:T>R>Y | |
| D. | 最高价氧化物的水化物酸性:T>R>Y |
分析 由短周期元素R、T、X、Y、Z在元素周期表的相对位置,R、T应在第二周期,X、Y、Z应在第三周期,设R的最外层电子数为x,则Y的最外层电子数为x,T、Z的最外层电子数为x+1,X的最外层电子数为x-1,它们的最外层电子数之和为31,则x+x+(x+1)×2+x-1=31,解得x=6,则R为O元素,X为P元素,Y为S元素,T为F元素,Z为Cl元素,然后结合元素性质及周期律来解答.
解答 解:由短周期元素R、T、X、Y、Z在元素周期表的相对位置,R、T应在第二周期,X、Y、Z应在第三周期,设R的最外层电子数为x,则Y的最外层电子数为x,T、Z的最外层电子数为x+1,X的最外层电子数为x-1,它们的最外层电子数之和为31,则x+x+(x+1)×2+x-1=31,解得x=6,则R为O元素,X为P元素,Y为S元素,T为F元素,Z为Cl元素,
A.R为O元素,位于元素周期表中第二周期第VIA族,故A错误;
B.电子层数越多半径越大,电子层数相同时,原子序数越大,半径越小,则原子半径:F<O<P,即T<R<X,故B错误;
C.非金属性越强,其氢化物越稳定,非金属性T>R>Y,则气态氢化物稳定性:T>R>Y,故C正确;
D.T为F元素,F元素没有最高价氧化物的水化物,故D错误;
故选C.
点评 本题考查位置、结构、性质的关系及应用,元素的推断为解答的关键,注意利用元素的位置及最外层电子数推断元素,把握元素周期律即可解答,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 一定条件下,2 mol SO2和1 mol O2混合在密闭容器中充分反应后容器中的分子数大于2NA | |
| B. | 256 g S8分子中含S-S键为7NA个.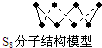 | |
| C. | 由1 mol CH3COONa和少量CH3COOH形成的中性溶液中,CH3COO-数目为NA个 | |
| D. | 1 mol Na与O2完全反应,生成Na2O和Na2O2的混合物,转移电子总数为NA个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气跟烧碱溶液反应:Cl2+OH-═Cl-+HClO | |
| B. | 漂白粉溶液中通入足量的SO2气体:Ca2++2ClO-+SO2+H2O═CaSO3↓+2HClO | |
| C. | 明矾溶液与氢氧化钡溶液反应,使SO42-恰好完全沉淀:Al3++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | |
| D. | 将氯气通入氯化亚铁溶液中:Fe2++Cl2═Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铈溶于氢碘酸的化学方程式可表示为:Ce+4HI=CeI4+2H2↑ | |
| B. | 四种铈的核素${\;}_{58}^{136}$Ce、${\;}_{58}^{138}$Ce、${\;}_{58}^{142}$Ce,它们互为同位素 | |
| C. | 用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+=Ce3++Fe3+ | |
| D. | 金属铈应储存于阴凉、通风的地方,包装要密封,不可与空气接触 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | Y | Z | M | R | Q | |
| 原子半径/nm | 0.186 | 0.074 | 0.099 | 0.143 | ||
| 主要化合价 | -4,+4 | -2 | -1,+7 | +3 | ||
| 其他 | 常温下该单质为黄色固体 | 无机非金属材料的主角 | 焰色反应呈黄色 | 其氧化物可做耐火材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正反应速率增大,逆反应速率减小 | |
| B. | 逆反应速率增大,正反应速率减小 | |
| C. | 正、逆反应速率均增大,但是逆反应速率增大的程度大于正反应速率增大的程度 | |
| D. | 正、逆反应速率均增大,而且增大的程度一样 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放热反应均是自发反应 | |
| B. | 如果△H和△S为均正值,当高温时,反应可能自发进行 | |
| C. | 物质的量增加的反应,△S为正值 | |
| D. | △S为正值的反应均是自发反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2O | B. | NO | C. | NO2 | D. | N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
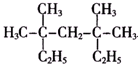 3,3,5,5-四甲基庚烷.
3,3,5,5-四甲基庚烷.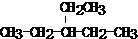 .
. .
.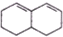 与Br2发生1,4-加成反应的化学方程式为
与Br2发生1,4-加成反应的化学方程式为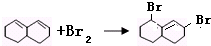 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com