
| 选项 | 实验事实 | 解释 |
| A | 加热蒸干MgSO4溶液能得到MgSO4固体;加热蒸干MgCl2溶液得不到MgCl2固体 | H2SO4不易挥发,HCl易挥发 |
| B | 电解CuCl2溶液,阴极得到Cu;电解NaCl溶液,阴极得不到Na | 得电子能力:Cu2+>Na+>H+ |
| C | 浓HNO3能氧化NO;稀HNO3不能氧化NO | HNO3浓度越大,氧化性越强 |
| D | 钠与乙醇反应平缓;钠与水反应剧烈 | 羟基中氢的活性:C2H5OH<H2O |
| A. | A | B. | B | C. | C | D. | D |
分析 A.HCl易挥发,加热氯化镁溶液生成氢氧化镁;
B.得电子能力H+>Na+;
C.浓硝酸氧化NO,说明具有较强的氧化性;
D.羟基中氢的活性越强,越易与钠反应.
解答 解:A.HCl易挥发,加热氯化镁溶液生成氢氧化镁,因硫酸不挥发,加热蒸干MgSO4溶液能得到MgSO4固体,可知与酸的挥发性有关,故A正确;
B.得电子能力H+>Na+,解释不正确,故B错误;
C.浓硝酸氧化NO,而稀硝酸不反应,可说明浓硝酸具有较强的氧化性,故C正确;
D.羟基中氢的活性越强,越易与钠反应,钠与乙醇反应平缓;钠与水反应剧烈,可说明羟基中氢的活性:C2H5OH<H2O,故D正确.
故选B.
点评 本题考查较为综合,涉及物质的性质、检验等知识,为高考常见题型,侧重考查学生的分析能力和实验能力,注意把握物质的性质以及实验的严密性和可行性的评价,难度不大.


科目:高中化学 来源: 题型:解答题
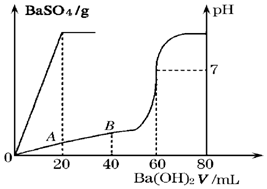 表中是不同温度下水的离子积的数据:
表中是不同温度下水的离子积的数据:| 温度/℃ | 25 | t1 | t2 |
| 水的离子积 | 1×10-14 | a | 1×10-12 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
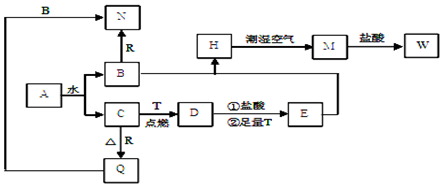

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
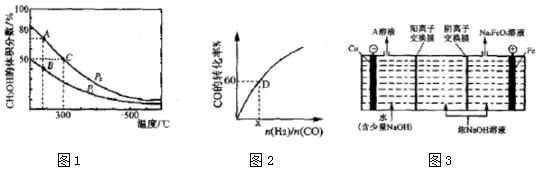
| 反应速率v | 平衡常数K | 平衡转化率α |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 陶瓷是硅酸盐产品 | B. | 葡萄糖可用于制镜业 | ||
| C. | 纸的主要成分为纤维素 | D. | 汉白玉的主要成分碳酸钙属于碱类 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径Y>Z>X | |
| B. | X分别与Y、Z形成的化合物均至少有两种 | |
| C. | 最高价氧化物对应水化物的酸性:W>Z | |
| D. | 氢元素在与X、Y、Z分别形成的化合物中,化合价均为+1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
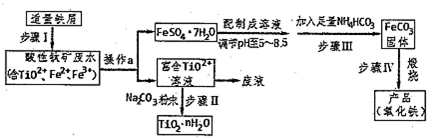
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com