
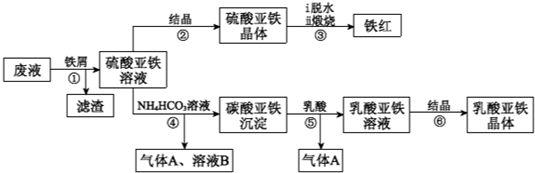
分析 (1)分离难溶固体和溶液的方法是用过滤.
(2)已知TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-,所以水解产物除生成TiO2•xH2O外,还有H2SO4.
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,根据电子得失守恒,化合价升降总数相等可算出氧化剂和还原剂的物质的量之比.
(4)根据碳酸亚铁的溶解平衡,乳酸会消耗CO32-,CO32-浓度降低后引起平衡移动.
(5)根据反应物和目标产物,特别是第5步加乳酸也产生了气体A,则可以确定气体A是二氧化碳.
(6)二价铁离子还原性强,易被氧化,第6步不要与氧气接触.
(7)用KMnO4与FeSO4•7H2O的关系来计算FeSO4•7H2O的物质的量,再计算出FeSO4•7H2O的质量,便可算出质量分数.
解答 解
(1)分离难溶固体和溶液的方法是用过滤.所以分离硫酸亚铁溶液和滤渣的操作是过滤.
故答案为:过滤
(2)已知TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-,所以水解产物除生成TiO2•xH2O外,还有H2SO4.
故答案为:TiOSO4+(x+1)H2O═TiO2•xH2O↓+H2SO4
(3)硫酸亚铁在空气中煅烧生成铁红和三氧化硫,说明氧化剂是O2,还原剂是FeSO4;1个O2下降4价,1个Fe2+上升1价,所以氧化剂与还原剂的关系为:O2 ~4FeSO4 .
故答案为:1:4
(4)溶解平衡为:FeCO3(s)?Fe2+(aq)+CO32-(aq),第5步加乳酸会消耗CO32-,产生二氧化碳气体,CO32-浓度降低后引起平衡右移,使碳酸亚铁溶解得到乳酸亚铁溶液.
故答案为:FeCO3(s)?Fe2+(aq)+CO32-(aq),CO32-与乳酸反应浓度降低,平衡向右移动,使碳酸亚铁溶解得到乳酸亚铁溶液
(5)第4步的反应物是FeSO4与NH4HCO3,产物有碳酸亚铁和气体A,第5步加乳酸也产生了气体A,则可以确定气体A是二氧化碳,参加反应的离子是Fe2+与HCO3-,产物有碳酸亚铁和二氧化碳,还有水生成.
故答案为:Fe2++2HCO3-═FeCO3↓+H2O+CO2↑
(6)二价铁离子还原性强,易被氧化,第6步不要与氧气接触.所以步骤6必须控制一定的真空度.
故答案为:防止Fe2+被氧化
(7)KMnO4与FeSO4•7H2O发生氧化还原反应,关系式为:KMnO4 ~5 FeSO4•7H2O,n(KMnO4)=C(KMnO4)•V(KMnO4)=0.1000mol•L-1 ×20.00×10-3 L,
所以n(FeSO4•7H2O)=5n(KMnO4)=5×0.1000mol•L-1 ×20.00×10-3 L,
所以m(FeSO4•7H2O)=n(FeSO4•7H2O)•M(FeSO4•7H2O)=5×0.1000mol•L-1 ×20.00×10-3 L×278g•mol-1=2.78 g,这是做实验用到的一部分20ml,一共是100ml,所以FeSO4•7H2O的总质量=2.78 g×5=13.9 g,样品有a g,所以晶体中FeSO4•7H2O的质量分数为:13.9/a
故答案为:13.9/a
点评 考查分离提纯的操作简单;水解离子方程式的书写要用到题中所给信息;陌生离子方程式的书写要从化工工艺流程中获取有用信息,对学生的要求较高;对氧化还原反应的考查较多,特别是定量计算,寻找关系式,都要用到得失电子守恒,化合价升降总数相等的知识,氧化还原反应的滴定是一个难点.平衡移动的知识考查了溶解平衡的知识,难度适中.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸氢钠溶液与少量氢氧化钙溶液混合:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- | |
| B. | 用石墨做电极电解硫酸铜溶液:2Cu2++2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+O2↑+4H+ | |
| C. | 向FeBr2溶液中通入等量的Cl2:2Br-+2Fe2++2Cl2═Br2+2Fe3++4Cl- | |
| D. | 向硫酸铝溶液中加入过量的氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,4.4gCO2和N2O混合物中所含有的原子数为0.3NA | |
| B. | 标准状况下2.24L己烷分子中含有1.9NA对共用电子 | |
| C. | 0.1molFe与0.1mol氯气反应时失去的电子数为0.3NA | |
| D. | 电解精炼铜时,阳极质量每减少32g,电路中就转移NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com