
 (1)对于Ag2S(s)?2Ag+(aq)+S2-(aq),其Ksp=c(Ag+)2•c(S2-)(写表达式).
(1)对于Ag2S(s)?2Ag+(aq)+S2-(aq),其Ksp=c(Ag+)2•c(S2-)(写表达式).分析 (1)依据沉淀溶解平衡的溶度积常数表示方法写出,溶度积等于溶液中离子浓度幂次方乘积;
(2)A、依据氯化银沉淀溶解平衡分析,银离子浓度增大,平衡向沉淀方向进行;
B、物质的溶解度大部分随温度的升高而增加,大部分物质的溶解是吸热的,有些物质溶解度随温度升高减小,有些物质溶解时放热的;
C、氢氧化铁是难溶物质,存在沉淀溶解平衡和电离平衡;
D、Mg(OH)2的溶解度比MgCO3小;
E、为使离子完全沉淀,加入过量的沉淀剂,能使离子沉淀完全;
(3)难溶电解质的溶解平衡及沉淀转化是溶解度大的物质向溶解度小的物质转化;
(4)在电解池的阳极发生失电子的氧化反应.
解答 解:(1)对于沉淀溶解平衡:Ag2S(s)?2Ag+(aq)+S2-(aq),一定温度下的饱和溶液中存在溶度积常数,Ksp=c(Ag+)2•c(S2-),
故答案为:c(Ag+)2•c(S2-);
(2)A、氯化银沉淀溶解平衡中存在溶度积常数,Ksp=[Ag+][Cl-],银离子浓度增大,平衡向沉淀方向进行;用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小,故A正确;
B、物质的溶解度大部分随温度的升高而增加,大部分物质的溶解是吸热的,有些物质溶解度随温度升高减小,有些物质溶解时放热的,故B错误;
C、氢氧化铁是难溶物质,存在沉淀溶解平衡和电离平衡,故C正确;
D、Mg(OH)2的溶解度比MgCO3小,故D错误;
E、为使离子完全沉淀,加入过量的沉淀剂,能使离子沉淀完全,故E正确;
故答案为:BD;
(3)难溶电解质的溶解平衡及沉淀转化是溶解度大的物质向溶解度小的物质转化,ZnS能转化为CuS,所以CuS的溶解度小于ZnS的溶解度,CuSO4溶液中电离出的Cu2+与S2-相遇结合生成溶度积更小的CuS[(1分)],使上述溶解平衡继续向右移动直至ZnS全部转化为CuS,
故答案为:CuSO4溶液中电离出的Cu2+与S2-相遇结合生成溶度积更小的CuS[(1分)],使上述溶解平衡继续向右移动直至ZnS全部转化为CuS;
(4)在电解池中,当阳极是活泼电极时,该电机本身发生失电子得还原反应,在碱性环境下,金属铜失去电子的电极反应为2Cu-2e-+2OH-=Cu2O+H2O,
故答案为:2Cu-2e-+2OH-=Cu2O+H2O.
点评 本题考查了沉淀溶解平衡的计算应用、平衡移动的影响因素、沉淀的转化以及电极反应式的书写,题目难度中等.


 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案科目:高中化学 来源: 题型:选择题
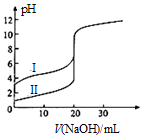 25℃时,用0.1000mol•L-1NaOH溶液分别滴定20.00ml 0.1000mol•L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )
25℃时,用0.1000mol•L-1NaOH溶液分别滴定20.00ml 0.1000mol•L-1的盐酸和醋酸,滴定曲线如图所示,下列说法正确的是( )| A. | Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线 | |
| B. | pH=7时,滴定盐酸和醋酸消耗NaOH溶液的体积相等 | |
| C. | V(NaOH)=10.00mL时,醋酸溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| D. | V(NaOH)=20.00mL时,两溶液中 c(CH3COO-)>c(Cl-) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳酸的电离方程式:H2CO3?2H++CO32- | |
| B. | 氯气通入水中:Cl2+H2O?2H++Cl-+ClO- | |
| C. | 往AgI悬浊液中滴加Na2S饱和溶液:2Ag+ (aq)+S2-(aq)=Ag2S(s) | |
| D. | 用醋酸除水垢:2CH3COOH+CaCO3=2CH3COO-+Ca2++H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该反应是复分解反应 | B. | 该反应1molCl2得到2mole- | ||
| C. | 反应中Cl2既是氧化剂,又是还原剂 | D. | NaClO2和ClO2中Cl的化合价相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向 Al2 (SO4 )3溶液中加入过量 NaOH 溶液 | |
| B. | 向 CuSO4 溶液中加入 NaOH 溶液 | |
| C. | 向 FeCl2 溶液中加入过量 NaOH 溶液 | |
| D. | 向 Na2SiO3溶液中加入稀盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaBH4的电子式为 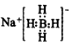 | |
| B. | 该反应在无水环境中进行 | |
| C. | NaBH4是很好的还原剂,常用于有机合成 | |
| D. | 1 molNaBH4与水充分反应可生成标况下44.8LH2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com