
| A. | Li在氧气中燃烧主要生成Li2O2 | |
| B. | At位于第七周期第ⅦA族,其气态氢化物的稳定性比HCl的强 | |
| C. | 卤族元素单质的熔、沸点随原子序数的增大而升高 | |
| D. | 第二周期非金属元素的气态氢化物溶于水后所得水溶液均呈酸性 |
分析 A、Li金属性比Na的弱,不生成Li2O2;
B、非金属性越强,氢化物越稳定;
C、组成结构相似的分子晶体,相对分子质量越大,熔沸点越高;
D、氨气溶于水,溶液显碱性.
解答 解:A、Li金属性比Na的弱,Li与氧气反应不生成Li2O2,生成Li2O,故A错误;
B、非金属性越强,氢化物越稳定,同主族从上到下非金属性依次减弱,则氢化物的稳定性依次减弱,所以砹的氢化物的稳定性小于氯化氢,故B错误;
C、组成结构相似的分子晶体,相对分子质量越大,熔沸点越高,卤族元素单质随原子序数相对分子质量增大,则熔沸点升高,故C正确;
D、第二周期非金属元素的气态氢化物溶于水后,水溶液不一定为酸性,如氨气溶于水,溶液显碱性,故D错误;
故选C.
点评 本题考查了元素周期律和元素周期表的应用,侧重于基础知识的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 反应中Cu2O只作氧化剂 | |
| B. | 若有28.8g Cu2O参加反应,则转移电子数为0.2NA | |
| C. | Cu2O的稳定性比CuO弱 | |
| D. | 如果溶液中出现蓝色,说明CuO已分解 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳原子之间,碳原子与其他原子(如氢原子)之间都可以形成4个共价键 | |
| B. | 碳原子性质活泼,可以与多数非金属元素原子形成共价键 | |
| C. | 碳原子之间既可以形成稳定的单键,又可以形成双键和三键 | |
| D. | 多个碳原子可以形成长度不同的链及环,且链、环之间又可以相互结合 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 原子序数116 | B. | 中子数177 | C. | 核外电子数116 | D. | 质子数177 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Mg2+、Zn2+、Cr3+、Fe3+ | B. | Cr3+、Fe3+、Zn2+、Mg2+ | ||
| C. | Fe3+、Cr3+、Zn2+、Mg2+ | D. | Zn2+、Mg2+、Cr3+、Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
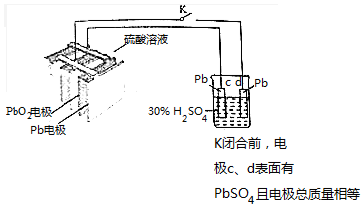
| A. | 铅蓄电池的结构中栅状极板应交替排列 | |
| B. | 铅蓄电池放电时Pb电极的电极反应为:Pb-2e-═Pb2+ | |
| C. | K闭合时,烧杯中SO42-向c电极迁移 | |
| D. | K闭合后,若c、d电极的质量相差3.2g,则转移的电子可能为0.2mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com