



 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:单选题
| A.铝在常温下不能与氧气反应 |
| B.铝在化学反应中容易失去电子,是氧化剂 |
| C.铝与盐酸或强碱溶液反应都能放出氢气 |
| D.氧化铝只能与酸反应,不能与碱反应 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe2O3(Al2O3)用盐酸 |
| B.Fe2O3(Al2O3)用氨水 |
| C.Mg(Al)用纯碱溶液 |
| D.MgCl2(AlCl3)用氢氧化钠溶液和盐酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.Fe(OH)2易被氧化成Fe(OH)3,说明稳定性: Fe(OH)2<Fe(OH)3 |
| B.铁是较活泼的金属,它与卤素(X2)反应的生成物均为FeX3 |
| C.氢氧化铁与氢碘酸反应:Fe(OH)3+3HI=FeI3+3H2O |
| D.铁元素位于周期表的第四周期第ⅧB族 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.②③ | B.①③ | C.①②③ | D.②③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.金属钠、钾在空气中易被氧化,应该在水中密封保存 |
| B.某气体能使酸性KMnO4溶液褪色,该气体一定是SO2 |
| C.Al(OH)3、NaHCO3和CaCO3均能用来治疗胃酸过多 |
| D.为了延长钢闸门的使用寿命,可将其与电源正极相连 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.原子半径:Na>Al |
| B.若把铝钠合金投入一定量的水中只得到无色溶液,则n(Al)≤n(Na) |
| C.m g不同组成的铝钠合金投入足量盐酸中,若放出H2越多,则铝的质量分数越小 |
| D.铝钠合金投入到足量氯化铜溶液中,肯定有氢氧化铜沉淀生成 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
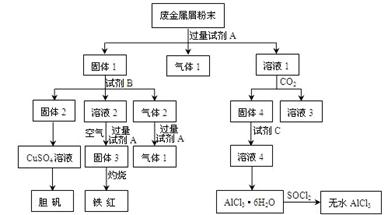
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com