


| n |
| V |
| n |
| V |


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
+ 4 |
+ 4 |
+ 4 |
| ||
查看答案和解析>>
科目:高中化学 来源: 题型:
| 溶解 |
| ① |
| BzCl2 |
| ② |
| NaOH |
| ③ |
| Na2CO3 |
| ④ |
| 过滤 |
| ⑤ |
| 适量盐酸 |
| ⑥ |
| 蒸发、结晶、烘干 |
| ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
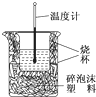 (1)在测定中和热的实验中,使用下列用品不是为了减小实验误差的是
(1)在测定中和热的实验中,使用下列用品不是为了减小实验误差的是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、12 mo1 |
| B、15 mo1 |
| C、16 mo1 |
| D、17 mo1 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作和现象 | 解释 | |
| A | 向某卤代烃在碱性条件下水解后的溶液中滴加硝酸银溶液,有白色沉淀产生,证明该卤代烃是氯代烃. | 因为氯代烃水解后的溶液中含Cl-,加入硝酸银溶液产生AgCl白色沉淀. |
| B | 向溴水中加入苯充分振荡,静置分层,且水层几乎无色. | 苯与溴水发生加成反应所以溴水褪色 |
| C | 要除去甲烷中混有的乙烯,可以将混合气体通入到酸性高锰酸钾溶液中,再通过浓硫酸干燥 | 因为乙烯可以被酸性高锰酸钾溶液氧化,而甲烷不能被氧化. |
| D | 向蔗糖在酸性条件下水解的溶液中加NaOH溶液直至呈碱性,再加入新制的Cu(OH)2悬浊液,加热,产生砖红色沉淀. | 说明蔗糖水解产生了葡萄糖. |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
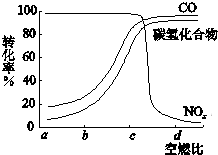 为使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.某研究性学习小组在技术人员的指导下,按下列流程探究某种催化剂在不同空燃比(空气与燃油气的质量比)条件下对汽车尾气的催化效果.
为使汽车尾气中的主要污染物(CO、NOx、碳氢化合物)进行相互反应,生成无毒物质,减少汽车尾气污染.某研究性学习小组在技术人员的指导下,按下列流程探究某种催化剂在不同空燃比(空气与燃油气的质量比)条件下对汽车尾气的催化效果.| 实验编号 | T/℃ | NO初始浓度mol?L-1 | CO初始浓度mol?L-1 | 催化剂的比表面积 m2?g-1 |
| Ⅰ | 280 | 1.2×10-3 | 5.8×10-3 | 82 |
| Ⅱ | 124 | |||
| Ⅲ | 350 | 124 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com