
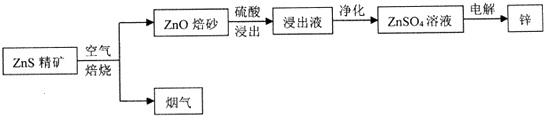
分析 硫化锌精矿焙烧得到ZnO及烟气,烟气中含有二氧化硫,ZnO焙砂用硫酸酸浸,浸出液中含有ZnSO4等,净化后得到硫酸锌溶液,再电解得到Zn.
(1)烟气中含有二氧化硫,可以制备硫酸;
(2)①在酸性条件下,用H2O2将Fe2+氧化成Fe3+,由电荷守恒,有氢离子参加反应,过氧化氢还原为水;
②选择的试剂能消耗氢离子,且不能引入新杂质;
④溶解平衡分别为:①Ag2SO4(s)?2Ag++SO42-,②AgCl(s)?Ag++Cl-,①-②×2可得:Ag2SO4+2Cl-?2AgCl+SO42-,故室温下该反应的平衡常数K=$\frac{Ksp(A{g}_{2}S{O}_{4})}{[Ksp(AgCl)]^{2}}$;
(3)Zn2+发生还原反应得到Zn,在阴极析出,阳极是溶液中氢氧根离子放电生成氧气.
解答 解:硫化锌精矿焙烧得到ZnO及烟气,烟气中含有二氧化硫,ZnO焙砂用硫酸酸浸,浸出液中含有ZnSO4等,净化后得到硫酸锌溶液,再电解得到Zn.
(1)烟气中含有二氧化硫,可以制备硫酸,故答案为:H2SO4;
(2)①在酸性条件下,用H2O2将Fe2+氧化成Fe3+,由电荷守恒,有氢离子参加反应,过氧化氢还原为水,反应离子方程式为:2Fe2++H2O2+2H+=2Fe3++2H2O,
故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;
②选择的试剂能消耗氢离子,且不能引入新杂质,加入硫酸不能消耗溶液中氢离子,NaOH、NH3•H2O、ZnO 均能消耗溶液中氢离子,但NaOH、NH3•H2O 会引入杂质离子,故选:C;
④溶解平衡分别为:①Ag2SO4(s)?2Ag++SO42-,②AgCl(s)?Ag++Cl-,①-②×2可得:Ag2SO4+2Cl-?2AgCl+SO42-,故室温下该反应的平衡常数K=$\frac{Ksp(A{g}_{2}S{O}_{4})}{[Ksp(AgCl)]^{2}}$=$\frac{6.0×1{0}^{-5}}{(2.0×1{0}^{-10})^{2}}$=1.5×1015,
故答案为:1.5×1015;
(3)Zn2+发生还原反应得到Zn,在阴极析出,阳极是溶液中氢氧根离子放电生成氧气,阳极电极反应式为:2H2O-4e-=O2↑+4H+ (或 4OH--4e-=O2↑+2H2O),
故答案为:阴;2H2O-4e-=O2↑+4H+ (或 4OH--4e-=O2↑+2H2O).
点评 本题考查物质制备工艺流程、物质的分离提纯、对操作的分析评价、溶度积有关计算、电解原理等,(2)中④可以用溶度积表示氯离子、硫酸根的浓度,再进行平衡常数计算.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 2-甲基-4-乙基戊烷 | B. | 3,4,4-三甲基己烷 | ||
| C. | 2,3-二甲基-1-戊烯 | D. | 1,2,4-三甲基-1-丁醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )
如图所示是Zn和Cu形成的原电池,某实验兴趣小组做完实验后,在读书卡上的记录如下,则卡片上的描述合理的是( )| A. | ①②③ | B. | ②④ | C. | ②③④ | D. | ③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 浓硫酸有强氧化性,铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.请你协助他们探究所得气体的成分.
浓硫酸有强氧化性,铁在冷的浓硫酸中能发生钝化.某兴趣小组的同学发现将一定量的铁与浓硫酸加热时,观察到铁完全溶解,并产生大量气体.请你协助他们探究所得气体的成分.查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 吸收塔中的硫元素可能以单质形式存在 | |
| B. | 中和池中只发生生成沉淀的复分解反应 | |
| C. | 在中和池中加入盐酸酸化的BaCl2溶液,可能产生白色沉淀 | |
| D. | 由题意分析得到,沉淀可能是Cr(OH)6 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径呈周期性变化 | |
| B. | 元素的化合价呈周期性变化 | |
| C. | 元素原子的核外电子排布呈周期性变化 | |
| D. | 第一电离能呈周期性变化 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com