
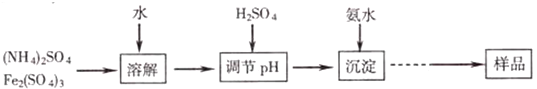
分析 (1)化合物中元素化合价代数和为0计算得到;
(2)若加入H2SO4将pH调节为2,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-2}}$=10-12mol/L,结合溶度积常数计算 铁离子浓度;
(3)取沉淀后的上层清液再加入盐酸酸化的氯化钡溶液观察是否生成沉淀判断;
(4)计算25ml溶液中铁离子和硫酸根离子物质的量之比,其中硫酸根离子物质的量和硫酸钡物质的量相同,铁离子物质的量计算依据滴定过程中发生的化学反应定量关系计算,2Fe3+~I2~2Na2S2O3;
解答 解:(1)在[KNH4Fex(SO4)y(OH)z]中,K元素化合价+1价,N元素化合价-3价,H元素化合价+1价,SO42-化合价代数和为-2价,OH-化合价代数和为-1价,+1+(-3)+(+1)×4++3x+(-2y)+(-1×z)=0,x、y、z的代数关系式为:3x+2=2y+z,
故答案为:3x+2=2y+z;
(2)若加入H2SO4将pH调节为2,c(OH-)=$\frac{1{0}^{-14}}{1{0}^{-2}}$=10-12mol/L,Ksp[Fe(OH)3])=4.0x10-38=c(Fe3+)c3(OH-),c(Fe3+)=$\frac{4.0×1{0}^{-38}}{(1{0}^{-12})^{3}}$=0.04mol/L,
故答案为:0.04;
(3)实验测定②,检验沉淀是否完全的方法是:静置,取生成沉淀后的上层清液1-2ml,滴加用盐酸酸化的氯化钡溶液,若无白色沉淀生成,则表明沉淀已完全,
故答案为:静置,取生成沉淀后的上层清液1-2ml,滴加用盐酸酸化的氯化钡溶液,若无白色沉淀生成,则表明沉淀已完全;
(4)①称取一定质量的样品加入稀盐酸中充分溶解,将所得溶液转移至容器瓶并配制成l00.00mL 溶液A.
②量取25.00mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32g.
③量取25.00mL溶液A,加入足量KI,用2.000mol•L-1Na2S2O3溶液进行滴定(已知反应为I2+2Na2S2O3═2NaI+Na2S4O6,消耗30.00mL Na2S2O3溶液至终点.
25ml溶液中硫酸根离子物质的量和硫酸钡物质的量相同,n(SO42-)=n(BaSO4)=$\frac{9,32g}{233g/mol}$=0.04mol,
2Fe3+~I2~2Na2S2O3
2 1 2
n(Fe3+)=2n(I2)=n(Na2S2O3)=2.000mol/L×0.03L=0.06mol,
样品中的n(Fe3+):n(SO42-)=0.06mol:0.04mol=3:2,
故答案为:n(SO42-)=n(BaSO4)=$\frac{9,32g}{233g/mol}$=0.04mol,
2Fe3+~I2~2Na2S2O3
2 1 2
n(Fe3+)=2n(I2)=n(Na2S2O3)=2.000mol/L×0.03L=0.06mol,
样品中的n(Fe3+):n(SO42-)=0.06mol:0.04mol=3:2.
点评 本题考查了物质组成实验测定、溶度积常数计算、滴定实验的过程分析和计算应用,掌握基础是解题关键,题目难度中等.


 天天练口算系列答案
天天练口算系列答案科目:高中化学 来源: 题型:推断题
 .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
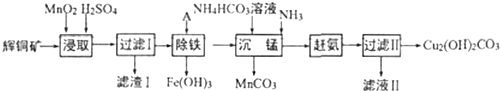
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 木炭在氧气中剧烈燃烧,生成黑色固体 | |
| B. | 铁丝在氧气中燃烧,火星四射 | |
| C. | 红磷在空气中燃烧,产生大量的白烟 | |
| D. | 硫在空气中燃烧,生成有刺激性气味气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠与水反应:Na+2H2O═Na++2OH-+H2↑ | |
| B. | Cu与浓硝酸反应制 NO2:Cu+4HNO3(浓)═Cu2++2 NO3-+NO2↑+2H2O | |
| C. | 向同浓度的NaOH和Na2CO3,的混合液中加少量稀盐酸:CO32-+2H+═CO2↑+3H2O | |
| D. | 将 NaHSO4与 Ba(OH)2溶液混合至中性:2H++SO42-+Ba2++2OH-═BaSO4↓+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
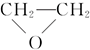 ③CH3CHO;④
③CH3CHO;④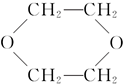 ⑤HO-CH2CH2OCH2CH2-OH.
⑤HO-CH2CH2OCH2CH2-OH.| A. | 只有① | B. | 只有①④ | C. | 只有①⑤ | D. | ①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com