
表为元素周期表的一部分,请参照元素①~⑨在表中的位置,用化学用语回答下列问题:
| 族 周期 | IA | | 0 | |||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅧA | |
| 2 | | | | ② | ③ | ④ | | |
| 3 | ⑤ | | ⑥ | ⑦ | | ⑧ | ⑨ | |
(1)酸性HClO4>H2SO4;C+2H2SO4(浓) CO2↑+2SO2↑+H2O
CO2↑+2SO2↑+H2O
(2)HNO3;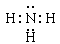 ;4NH3+5O2
;4NH3+5O2 4NO+6H2O
4NO+6H2O
(3)Al-3e-+4OH-=AlO2-+2H2O;SO2-2e-+2H2O=SO42-+4H+;硫酸
解析试题分析:(1)⑧是S,⑨是Cl。由于非金属性越强,最高价氧化物的水化物的酸性越强,所以证明⑨的非金属性比⑧强的实验事实是酸性HClO4>H2SO4;②是碳元素,则单质碳和浓硫酸反应的方程式是C+2H2SO4(浓) CO2↑+2SO2↑+H2O。
CO2↑+2SO2↑+H2O。
(2)①、③、④分别是H、N、O,Z的浓溶液常温下能使铁钝化,由此可知Z的化学式为HNO3;W中①、③两种元素的质量比为3:14,则H和N原子的个数之比是3:1,因此W是氨气,含有极性键的共价化合物,其电子式是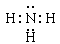 ;在催化剂的作用下氨气能被氧气氧化食醋NO和水,反应的化学方程式是4NH3+5O2
;在催化剂的作用下氨气能被氧气氧化食醋NO和水,反应的化学方程式是4NH3+5O2 4NO+6H2O。
4NO+6H2O。
(3)⑥是铝,在反应中失去电子,所以做负极。由于电解质是氢氧化钠溶液,所以电池负极的电极反应是Al-3e-+4OH-=AlO2-+2H2O。能形成酸雨的S的氧化物是二氧化氯,在反应中失去电子,所以在负极通入,氧气得到电子,在正极通入,则负极电极反应式是SO2-2e-+2H2O=SO42-+4H+,由于正极是氧气得到电子,所以该电池的产物应该是硫酸。
考点:考查元素周期表的结构、元素周期律的应用、电子式、化学方程式以及电极反应式的书写
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,侧重对学生基础知识的巩固和训练,有利于提高学生的逻辑推理能力和应试能力。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度,考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。


科目:高中化学 来源: 题型:
| 族周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
查看答案和解析>>
科目:高中化学 来源:2011-2012学年浙江省嘉兴市八校联考高一(下)期中化学试卷(解析版) 题型:填空题
| 族周期 | IA | |||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | ⑤ | ||||
| 3 | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | |||
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com