
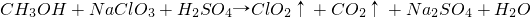 (方程式未配平).下列有关说法不正确的是
(方程式未配平).下列有关说法不正确的是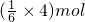 ×22.4L/mol=14.9L CO2(标准状况),故D错误;
×22.4L/mol=14.9L CO2(标准状况),故D错误;

 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaC1O3中氯元素得电子,化合价降低被还原 | B、该反应中反应物的总能量一定大于生成物的总能量 | C、NaC1O3和Na2SO4都属于离子化合物,且都含有共价键 | D、反应过程中,每转移4mol电子生成22.4L CO2(标准状况) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、甲醇是氧化剂 | B、通过反应可判断NaClO3的氧化性强于Na2SO4 | C、还原产物和氧化产物的物质的量之比为6:l | D、生成1molCO2时转移电子的物质的量为4mol |
查看答案和解析>>
科目:高中化学 来源: 题型:
A.氧化剂是甲醇
B.氧化产物是二氧化氯
C.还原产物与氧化产物的物质的量之比为6∶1
D.氧化剂与还原剂的物质的量之比为2∶1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com