
分析 热化学方程式的书写:标明物质的聚集状态;焓变符号中的“+”和“-”代表吸热和放热,化学反应的焓变和物质的量相对应.
解答 解:(1)发生反应C+H2O=CO+H2,1mol石墨反应吸收的热量为56.7kJ×$\frac{1mol×12g/mol}{6g}$=113.4kJ,故该反应热化学方程式为:C(s 石墨)+H2O(g)=CO(g)+H2(g)△H=+113.4kJ/mol,
故答案为:C(s 石墨)+H2O(g)=CO(g)+H2(g)△H=+113.4kJ/mol;
(2)3molNO2气体溶于水生成HNO3和NO气体,放出138kJ热量,其热化学方程式为:3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-138kJ/mol,
故答案为:3NO2(g)+H2O(l)=2HNO3(aq)+NO(g)△H=-138kJ/mol;
(3)甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃,生成SiO2和水,常温下1g甲硅烷自燃放出的热量为44.6KJ,则1mol SiH4反应放出的热量为44.6kJ×32=1427.2kJ,其热化学方程式为SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1427.2kJ/mol,
故答案为:SiH4(g)+2O2(g)=SiO2(s)+2H2O(l)△H=-1427.2kJ/mol.
点评 本题考查热化学方程式书写与判断,比较基础,注意掌握热化学方程书写规则.


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 23 g Na与足量H2O反应完全后可生成NA个H2分子 | |
| B. | 1 mol Na2O2和足量CO2反应转移2 NA个电子 | |
| C. | 标准状况下,22.4 L N2和H2混合气中含NA个原子 | |
| D. | 3 mol单质Fe完全转变为Fe3O4,失去8 NA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
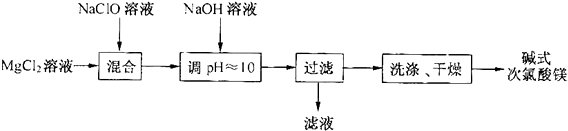
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ).聚碳酸酯不耐高温,100℃时释放出的双酚A是25℃时的50倍.双酚A进入人体后,会溶解在身体的血管里,导致致命性的血管疾病.请回答下列问题:
).聚碳酸酯不耐高温,100℃时释放出的双酚A是25℃时的50倍.双酚A进入人体后,会溶解在身体的血管里,导致致命性的血管疾病.请回答下列问题: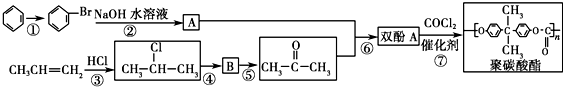
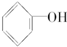 .
.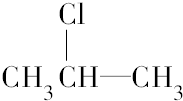 按系统命名法的名称为2-氯丙烷.
按系统命名法的名称为2-氯丙烷.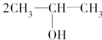 +O2$→_{△}^{催化剂}$
+O2$→_{△}^{催化剂}$ +2H2O.
+2H2O. ,
,查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
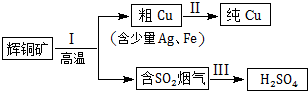
| 所含离子 | Na+ | HCO3- | CO32- | SO32- | HSO3- |
| 浓度mol/L | 0.005 | 0.01 | 0.05 | 0.2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com