
在下列事实中,什么因素影响了化学反应速率?
①天的食品易霉变,冬天就不易发生该现象 。
②熔化的氯酸钾放出气泡较慢,撒入少量二氧化锰很快产生气体 。
③工业上常将固体燃料粉碎,以提高燃烧效率 。
④同体积、同浓度的盐酸与同样大小的锌条和镁条反应,产生气体前慢后快 。
⑤同体积、同浓度的硫酸和盐酸与同样大小质量相等的锌粒反应,产生气体前者快 。
①温度,②催化剂,③固体表面积,④反应物本身的性质,⑤氢离子浓度
解析试题分析:可以根据影响化学反应速率的因素方面进行分析、判断,从而得出正确的结论。
①夏天的食品易霉变,冬天就不易发生该现象,这是由于夏天气温高,故食品易霉变,而冬天气温低不易发生该现象,因此温度高低对反应速率有影响,温度越高反应速率越快。
②熔化的氯酸钾放出气泡很慢,若加入少量Mn02时分解加速.说明化学反应速率受催化剂的影响。
③固体燃料粉碎,燃烧更快.说明反应物的接触面积越大,反应的速率大。
④同浓度、同体积的盐酸中放入同样大小的锌粒和镁条,产生气体有快有慢,这说明越小化学反应速率的因素是反应物自身的性质。
⑤同体积、同浓度的硫酸和盐酸与同样大小质量相等的锌粒反应,产生气体前者快,这是由于溶液中氢离子的浓度不同引起的,氢离子浓度越大,反应速率越快。
考点:考查外界条件对化学反应速率的影响
点评:该题是基础性试题的考查,难度不大。明确反应速率的含义以及影响因素是答题的关键。因此解答本题时要充分理解影响化学反应速率的因素,然后才能对问题做出正确的判断。


科目:高中化学 来源: 题型:填空题
甲醇是重要的化工原料和清洁液体燃料。工业上可利用CO或CO2来生产甲醇。甲醇制
备的相关信息如下表: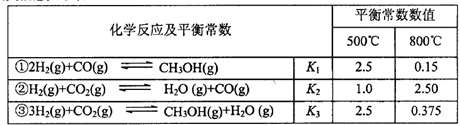
(1)反应②是____反应(选填“吸热”“放热”)。
(2)据上表信息推导出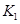 、
、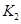 与
与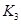 之间的关系,
之间的关系,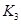 =______用
=______用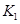 、
、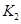 表示)。500℃时测得反应③在某时刻,
表示)。500℃时测得反应③在某时刻,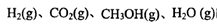 的浓度(mol/L)分别为0 8、0.1、0 3、0 15,此时
的浓度(mol/L)分别为0 8、0.1、0 3、0 15,此时 (选填“>”“<”“=”)。
(选填“>”“<”“=”)。
(3)若某温度下反应①从开始到平衡CO和CH3OH的浓度变化如图一所示,则用H2浓度变化表示此段时间内该反应的平均速.v(H2)= 若某温度下反应①中H2的平衡转化率(a)与体系总压强(P)的关系如图二所示,则平衡状态由A变到B时,平衡常数 (选填“>”“<”“=”)。
(选填“>”“<”“=”)。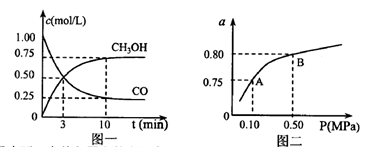
(4)一定温度下,在体积固定的密闭容器中发生反应②,可判断该反应已经达到平衡的是____。(用相应字母表示)
| A.容器中总压强不变 |
| B.混台气体的平均摩尔质量也始终保持不变, |
| C.混合气体的密度不变 |
| D.CO2(g)或CO(g)的浓度不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(1)常温下,将2种一元酸分别和NaOH溶液等体积混合,实验数据如下:
| 组别 | 一元酸 | NaOH | pH |
| 甲 | c(HX)=0.1mol/L | c(NaOH)=0.1mol/L | pH=9 |
| 乙 | c(HY)=c1mol/L | c(NaOH)=0.1mol/L | pH=7 |
 CH3OH(g) △H
CH3OH(g) △H| 温度 | 523K | 573K | 623K |
| 平衡常数(K) | 2.041 | 0.270 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
氮及其化合物在工农业生产中具有重要作用。
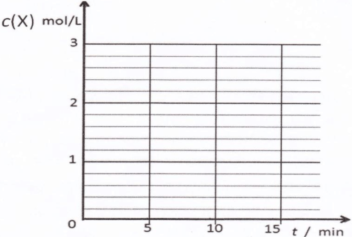
(1)某小组进行工业合成氨N2(g)+3H2(g) 2NH3(g) △H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。
2NH3(g) △H<0的模拟研究,在1L密闭容器中,分别加入0.1mol N2和0.3mol H2。实验①、②、③中c(N2)随时间(t)的变化如图所示。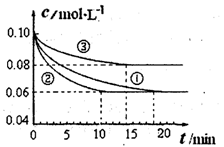
实验②从开始到达到平衡状态的过程中,用H2表示的平均反应速率为 。与实验①相比,.实验②所采用的实验条件可能为 (填字母),实验③所采用的实验条件可能为 (填字母)。
a.增大压强b.减小压强c.升高温度d.降低温度e.使用催化剂
(2)NH3可用于处理废气中的氮氧化物,其反应原理为2NH3(g)+NO(g)+NO2(g) 2N2(g)+3H2O(g) △H<0欲提高废气中氮氧化物的转化率,可采取的措施是 (填字母)
2N2(g)+3H2O(g) △H<0欲提高废气中氮氧化物的转化率,可采取的措施是 (填字母)
a.升高温度 b.增大压强 c,增大NH3的浓度
(3)NCl3遇水发生水解反应,生成NH3的同时得到 (填化学式)。ClO2是广谱高效消毒剂,制备原理为NCl3+6ClO2-+3H2O=NH3↑+6ClO2+3OH-+3Cl-。若转移1mol电子,则制取ClO2的质量为 。
(4)25℃时,将amol·L-1的氨水与bmol·L-1盐酸等体积混合,反应后溶液恰好显中性,则a b(填“>”、“<”或“=”)。用a、b表示NH3·H2O的电离平衡常数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
已知2A(g)+B(g)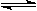 2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)="0.040" mol·L-1,放出热量Q1kJ。
2C(g),向容积为1L的密闭容器中加入0.050 mol A和0.025mol B,在500℃时充分反应,达平衡后测得c(C)="0.040" mol·L-1,放出热量Q1kJ。
⑴能说明上述反应已经达到化学平衡状态的是 (填写序号)
a.v(C)=2v(B) b.容器内压强保持不变
c.v逆(A)=2v正(B) d.容器内气体的密度保持不变
⑵若在相同的容器中只加入0.050 mol C,500℃时充分反应达平衡后,吸收热量Q2kJ,则Q1与Q2之间的关系式可表示为 (用含Q1、Q2的代数式表示);
⑶500℃时,上述反应的化学平衡常数K= ;
⑷已知:K(300℃)>K(350℃),该反应是 (填“放”或“吸”)热反应;若反应温度升高,A的转化率 (填“增大”、“减小”或“不变”);
⑸某温度下,A的平衡转化率(a)与体系总压强(P)的关系如图所示,平衡状态由a变到b时,化学平衡常数K(A) K(B)(填“>”、“<”或“=”)。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
在一个容积固定的反应器中,有一可左右滑动的密封隔板,左、右两侧分别进行如下可逆反应:2SO2(g)+O2(g) 2SO3(g);
2SO3(g);
3Fe(s)+4H2O(g)  Fe3O4(g)+4H2(g)。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25mol、1mol;右侧中加入9 mol的水蒸气和适量的铁粉(忽略铁粉对容器体积的影响)。
Fe3O4(g)+4H2(g)。左侧中加入SO2、O2、SO3的物质的量分别为x mol、3.25mol、1mol;右侧中加入9 mol的水蒸气和适量的铁粉(忽略铁粉对容器体积的影响)。
当x在一定范围内变化时,均可以通过调节反应器的温度,使两侧反应都达到平衡,并且隔板恰好处于反应器位置2处。请填写以下空白:
(1)若x=1.5,则左侧反应在起始时向__________(填“正反应”或“逆反应”)方向进行。欲使反应维持向该方向进行,则x的取值范围是________________。
(2)若x=2,则左侧反应在起始时向__________(填“正反应”或“逆反应”)方向进行,平衡时混合气中SO2所占的体积分数为_________。
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(16分)NO和NO2是常见的氮氧化物,研究它们的综合利用有重要意义。
(1)氮氧化物产生的环境问题有 (填一种)。
(2)氧化—还原法消除氮氧化物的转化如下: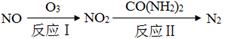
①反应Ⅰ为:NO+O3=NO2+O2,生成11.2 L O2(标准状况)时,转移电子的物质的量是 mol。
②反应Ⅱ中,当n(NO2)∶n[CO(NH2)2]=3∶2时,反应的化学方程式是 。
(3)硝化法是一种古老的生产硫酸的方法,同时实现了氮氧化物的循环转化,主要反应为:
NO2(g)+SO2(g) SO3(g)+NO(g) △H=-41.8 kJ·mol-1
SO3(g)+NO(g) △H=-41.8 kJ·mol-1
①已知:2SO2(g)+O2(g) 2SO3(g) △H=-196.6 kJ·mol-1
2SO3(g) △H=-196.6 kJ·mol-1
写出NO和O2反应生成NO2的热化学方程式 。
②一定温度下,向2 L恒容密闭容器中充入NO2和SO2各1 mol,5min达到平衡,此时容器中NO 和NO2的浓度之比为3∶1,则NO2的平衡转化率是 。
③上述反应达平衡后,其它条件不变时,再往容器中同时充入
NO2、SO2、SO3、NO各1mol,平衡 (填序号)。
A.向正反应方向移动
B.向逆反应方向移动
C.不移动
(4)某化学兴趣小组构想将NO转化为HNO3,装置如图,电极为多孔惰性材料。则负极的电极反应式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
碳、氮和铝的单质及其化合物在工农业生产和生活中有重要的作用。
(1)真空碳热还原—氯化法可实现由铝矿制备金属铝,其相关的热化学方程式如下:
2Al2O3(s)+2AlCl3(g)+6C(s)=6AlCl(g)+6CO(g) △H=a kJ·mol-1
3AlCl(g) =2Al(l)+AlCl3(g) △H=b kJ·mol-1
反应Al2O3(s)+3C(s)=2Al(l)+3CO(g)的△H= kJ·mol-1(用含a、b的代数式表示);
(2)用活性炭还原法可以处理氮氧化物。某研究小组向某密闭容器中加入一定量的活性炭和NO,发生反应C(s)+2NO(g) N2(g)+CO2(g) △H="Q" kJ·mol-1在T1℃时,反应进行到不同时间测得各物质的浓度如下:
N2(g)+CO2(g) △H="Q" kJ·mol-1在T1℃时,反应进行到不同时间测得各物质的浓度如下:
| 时间(mol/L) 浓度(mol/L) | 0 | 10 | 20 | 30 | 40 | 50 |
| NO | 1.00 | 0.68 | 0.50 | 0.50 | 0.60 | 0.60 |
| N2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
| CO2 | 0 | 0.16 | 0.25 | 0.25 | 0.30 | 0.30 |
查看答案和解析>>
科目:高中化学 来源: 题型:问答题
(15分)光气(COCl2)在塑料、制革、制药等工业中有许多用途,工业上采用高温下CO与Cl2在活性炭催化下合成。
(1)实验室常用来制备氯气的化学方程式为 ;
(2)工业上利用天然气(主要成分为CH4)与CO2进行高温重整制备CO,已知CH4、H2、和CO的燃烧热(ΔH)分别为-890.3kJ·mol-1、-285.8kJ.mol-1和-283.0kJ.mol-1,则生成1m3(标准状况)CO所需热量为 ;
(3)实验室中可用氯仿(CHCl3)与双氧水直接反应制备光气,其反应的化学方程式为
;
(4)COCl2的分解反应为COCl2(g)=Cl2(g)+CO(g) ΔH=+108kJ·mol-1。反应体系达到平衡后,各物质的浓度在不同条件下的变化状况如下图所示(第10min到14min的COCl2浓度变化曲线未示出):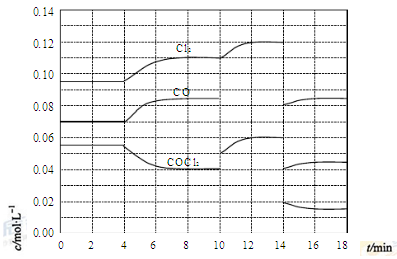
①计算反应在第8min时的平衡常数K= ;
②比较第2min反应温度T(2)与第8min反应温度T(8)的高低:T(2) T(8)
(填“<”、“>”或“=”),
③若12min时反应于温度T(8)下重新达到平衡,则此时c(COCl2)= mol·L-1;
④比较产物CO在2-3min、5-6min和12-13min时平均反应速率(平均反应速率分别以v(2-3)、v(5-6)、v(12-13))的大小 ;
⑤比较反应物COCl2在5-6min和15-16min时平均反应速率的大小:v(5-6) v(15-16)(填“<”、“>”或“=”),原因是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com