
(12分)影响化学反应速率的因素很多,某课外兴趣小组用实验的方法通过图1所示装置研究反应速率的有关问题。
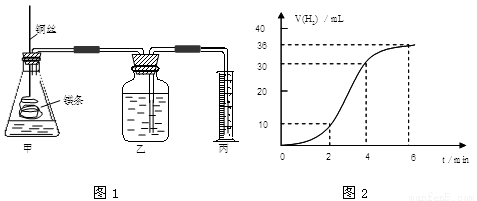
(1)取一段镁条,用砂纸擦去表面的氧化膜,使镁条浸入锥形瓶内足量的稀盐酸中。足量镁条与一定量盐酸反应生成H2的量与反应时间的关系曲线如图2所示。
①请在图3的方框中画出上述反应的速率与时间的关系曲线。
②在前4min内,镁条与盐酸的反应速率逐渐加快,在4min之后,反应速率逐渐减慢,请简述其原因: 。
(2)某同学发现,纯度、质量、表面积都相同的两铝片与H+浓度相同的盐酸和硫酸在同温同压下反应时产生氢气的速率差别很大,铝和盐酸反应速率更快。他决定对其原因进行探究。填写下列空白:
①该同学认为:由于预先控制了反应的其他条件,那么,两次实验时反应的速率不一样的原因,只有以下五种可能:
原因Ⅰ:Cl-对反应具有促进作用,而SO2- 4对反应没有影响;
原因Ⅱ:Cl-对反应没有影响,而SO2- 4对反应具有阻碍作用;
原因Ⅲ: ;
原因Ⅳ:Cl-、SO2- 4均对反应具有促进作用,但Cl-影响更大;
原因Ⅴ: 。
②该同学设计并进行了两组实验,即得出了正确结论。他取了两片等质量、外形和组成相同、表面经过砂纸充分打磨的铝片,分别放入到盛有同体积、c(H+)相同的稀硫酸和盐酸的试管(两试管的规格相同)中:
a.在盛有硫酸的试管中加入少量 固体 ,观察反应速率是否变化;
b.在盛有盐酸的试管中加入少量 固体,观察反应速率是否变化。
通过观察到实验a和实验b现象,从而得出结论。
(1) ①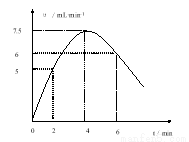 (图中要标明2、4、6min时刻时的速率及要画出速率走向弧线)
(图中要标明2、4、6min时刻时的速率及要画出速率走向弧线)
② 镁和盐酸反应是放热反应,随着反应体系温度升高,反应速率增大;4min后由于溶液中H+ 浓度
降低,所以导致反应速率减小 。⑵①Ⅲ:Cl-对反应具有促进作用,而SO2- 4对反应具有阻碍作用;(Ⅲ、Ⅴ可互换) Ⅴ:Cl-、SO2- 4均对反应具有阻碍作用,但Cl-影响更小(或SO2- 4影响更大) ② NaCl Na2SO4
【解析】
试题解析:(1)①2、4、6min时刻时氢气体积的分别为10 mL、20mL、36mL,其平均反应速率分别为5 mL/min、
7.5mL/min、6mL/min,然后标出速率与时间图象,故答案为:
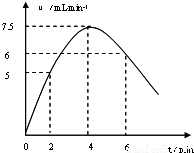
②该反应是放热反应,随着反应的进行,放出的热量越多,溶液的温度越高,反应速率越大;随着反应的进行,溶液中氢离子的浓度逐渐减小,浓度越小,反应速率越小;(2)①总结原因Ⅰ和原因Ⅱ,提出原因Ⅲ:Cl-对反应具有促进作用,而SO2- 4对反应具有阻碍作用;根据原因Ⅳ结合题意,提出与原因Ⅳ相反的观点:Cl-、SO42-均对反应具有阻碍作用,但Cl-影响更小(或SO42-影响更大);②a中原来时快有硫酸根离子,后加入氯离子,如果氯离子有促进作用,那么反应速率就比未加时快,以此证明原因Ⅲ是正确的,故应加入NaCl;b中中原来时快有氯离子,后加入硫酸根离子,如果硫酸根离子有阻碍作用,那么反应速率比未加时慢,以此说明因Ⅲ是正确的,故应加入 Na2SO4。
考点:化学反应速率的影响因素


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2014-2015学年浙江省杭州市高二10月月考化学试卷(解析版) 题型:选择题
如图,a、b是石墨电极,通电一段时间后,b极附近溶液显红色。下列说法正确的是( )。
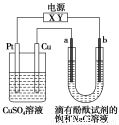
A.X极是电源负极,Y极是电源正极
B.a极的电极反应是2Cl--2e-===Cl2↑
C.电解过程中CuSO4溶液的pH逐渐增大
D.Pt极上有6.4 g Cu析出时,b极产生2.24 L(标准状况)气体
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中考试化学试卷(解析版) 题型:填空题
(8分)氨在国民经济中占有重要地位。
(1)已知合成氨反应:N2(g)+3H2(g) 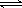 2NH3(g) ΔH < 0;在某密闭容器中充入合成氨的原料气(N2、H2),一定时间后达到平衡。为提高氨合成反应速率,同时使平衡向氨合成方向移动。下列措施可行的是 (填写编号)
2NH3(g) ΔH < 0;在某密闭容器中充入合成氨的原料气(N2、H2),一定时间后达到平衡。为提高氨合成反应速率,同时使平衡向氨合成方向移动。下列措施可行的是 (填写编号)
① 升高温度; ② 缩小容器体积(加压); ③ 选择高效催化剂; ④ 在恒容条件下,再充入合成氨的原料气(N2、H2); ⑤在恒容条件下,再充入原平衡的混合气;⑥在恒容条件下,分离出氨气。
(2)工业生产尿素的原理是以NH3和CO2为原料合成尿素[CO(NH2)2],反应的化学方程式为:2NH3 (g)+ CO2 (g)  CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
CO(NH2)2 (l) + H2O (l),该反应的平衡常数和温度关系如下:
T / ℃ | 165 | 175 | 185 | 195 |
K | 111.9 | 74.1 | 50.6 | 34.8 |
ΔH(填“>”、“<”或“=”) 0。
②在一定温度和压强下,若原料气中的NH3和CO2的物质的量之比(氨碳比)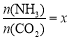 ,下图是氨碳比(x)与CO2平衡转化率(α%)的关系。α随着x增大而增大的原因是 。
,下图是氨碳比(x)与CO2平衡转化率(α%)的关系。α随着x增大而增大的原因是 。

③上图中的B点处,NH3的平衡转化率为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中考试化学试卷(解析版) 题型:选择题
高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为: 3Zn+2K2FeO4+8H2O 3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是:
3Zn(OH)2 + 2Fe(OH)3 + 4KOH,下列叙述不正确的是:
A.放电时负极反应为:Zn-2e—+2OH—=Zn(OH)2
B.充电时阳极反应为:Fe(OH)3 -3e—+ 5OH—=FeO42-+ 4H2O
C.放电时每转移3mol电子,正极有1molK2FeO4被氧化
D.放电时正极附近溶液的碱性增强
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省高二上学期期中考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.镀铜铁制品镀层受损后,铁制品比受损前更容易生锈
B.铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀
C.铅蓄电池放电时的负极和充电时的阳极均发生还原反应
D.在潮湿的碱性环境中,金属的电化学腐蚀主要是析氢腐蚀
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省东阳外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
反应PCl5(g) PCl 3(g)+Cl2(g) ①;
PCl 3(g)+Cl2(g) ①;
2HI(g) H2(g)+I2(g) ②;
H2(g)+I2(g) ②;
2NO2(g) N2O4(g) ③;
N2O4(g) ③;
在一定条件下,达到化学平衡时,反应物的转化率均是a%。若保持各自的温度不变、体积不变,分别再加入一定量的各自的反应物,则转化率
A.均不变 B.均增大
C.①增大,②不变,③减少 D.①减少,②不变,③增大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江省东阳外国语学校高二上学期期中化学试卷(解析版) 题型:选择题
已知:SO2(g)+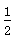 O2(g)
O2(g) 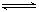 SO3(g) ΔH=-98 kJ/mol。某温度下,向一体积为2 L的密闭容器中充入0.2 mol SO2和0.1 mol O2,5 min后达到平衡,共放出热量11.76 kJ,下列说法正确的是
SO3(g) ΔH=-98 kJ/mol。某温度下,向一体积为2 L的密闭容器中充入0.2 mol SO2和0.1 mol O2,5 min后达到平衡,共放出热量11.76 kJ,下列说法正确的是
A.5 min内用O2表示的反应速率为0.12 mol/(L·min)
B.该反应的平衡常数数值为7.5
C.SO2的平衡转化率为60%
D.加入催化剂,可使ΔH变小
查看答案和解析>>
科目:高中化学 来源:2014-2015学年浙江台州中学高二上学期第一次统练化学试卷(解析版) 题型:填空题
(14分)碘在科研与生活中有重要应用,某兴趣小组用0.50 mol·L-1 KI、0.2%淀粉溶液、0.20 mol·L-1 K2S2O8、0.10 mol·L-1 Na2S2O3等试剂,探究反应条件对化学反应速率的影响。
已知:S2O82-+2I- 2SO42-+I2(慢) I2+2S2O32-
2SO42-+I2(慢) I2+2S2O32-  2I-+ S4O62-(快)
2I-+ S4O62-(快)
(1)向KI、Na2S2O3与淀粉的混合溶液中加入一定量的K2S2O8溶液,当溶液中的 耗尽后,溶液颜色将由无色变为蓝色,为确保能观察到蓝色,S2O32-与S2O82-初始的物质的量需满足的关系为:n(S2O32-)∶n(S2O82-) 。
(2)为探究反应物浓度对化学反应速率的影响,设计的实验方案如下表:
实验序号 | 体积V/mL | ||||
K2S2O8溶液 | 水 | KI溶液 | Na2S2O3溶液 | 淀粉溶液 | |
① | 10.0 | 0.0 | 4.0 | 4.0 | 2.0 |
② | 9.0 | 1.0 | 4.0 | 4.0 | 2.0 |
③ | 8.0 | Vx | 4.0 | 4.0 | 2.0 |
表中Vx mL,理由是 。
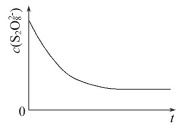
(3)已知某条件下,浓度c(S2O82-)反应时间t的变化曲线如图所示,若保持其他条件不变,请在答题卡坐标图中,分别画出降低反应温度和加入催化剂时c(S2O82-)-t的变化曲线示意图(进行相应的标注)
(4)碘也可用作心脏起搏器电源-锂碘电池的材料,该电池反应为:
2Li(s)+I2(s) 2LiI(s) ΔH
2LiI(s) ΔH
已知: ①4Li(s)+O2(g) 2Li2O(s) ΔH1
2Li2O(s) ΔH1
②4LiI(s)+O2(g) 2I2(s)+2Li2O(s) ΔH2
2I2(s)+2Li2O(s) ΔH2
则电池反应的ΔH= ;碘电极作为该电池的 极。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年河南鄢陵县第一高中高二上第一次考试化学(B)试卷(解析版) 题型:选择题
已知:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(l) ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是
A.H2(g)的燃烧热为571.6 kJ·mol -1
B.同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C.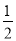 H2SO4(aq)+
H2SO4(aq)+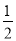 Ba(OH)2(aq)=
Ba(OH)2(aq)=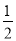 BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D.3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com