
| A. | 常温下,PH=9的碳酸钠溶液中由水电离出的c(OH-)=1×10-9mol•L-1 | |
| B. | 饱和氯水中:c(Cl-)=c(ClO-)+c(HClO) | |
| C. | 将pH=4的醋酸溶液稀释后,溶液中所有离子的浓度均降低 | |
| D. | 中和等体积pH相同的H2SO4和HCl溶液,消耗NaOH的物质的量为2:1 |
分析 A.水电离出的c(OH-)=$\frac{Kw}{c({H}^{+})}$;
B.饱和氯水中存在物料守恒;
C.加水稀释醋酸溶液中,醋酸中c(OH-)增大;
D.pH相等的盐酸和硫酸,氢离子浓度相等.
解答 解:A.水电离出的c(OH-)=$\frac{Kw}{c({H}^{+})}$mol/L=1×10-5mol•L-1,故A错误;
B.饱和氯水中存在物料守恒:c(Cl-)=c(ClO-)+c(HClO),故B正确;
C.加水稀释醋酸溶液中,溶液中氢离子浓度减小,温度不变水的离子积常数不变,则醋酸中c(OH-)增大,故C错误;
D.等体积等pH的硫酸和盐酸,氢离子物质的量相等,消耗氢氧化钠的物质的量相等,故D错误;
故选B.
点评 本题考查了盐类水解及弱电解质的电离,注意A中水电离出氢氧根离子浓度计算方法,注意水的离子积常数与溶液酸碱性及电解质强弱无关,只与温度有关,为易错点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 A、B、C、D、E五种物分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:
A、B、C、D、E五种物分别是NaOH、NH3•H2O、CH3COOH、HCl、NH4HSO4中的一种.常温下进行下列实验:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能够发生化学反应的碰撞是有效碰撞 | |
| B. | 增大浓度会加快化学反应速率,其原因是增加了单位体积内活化分子的数目 | |
| C. | 稀溶液中:H+(aq)+OH-(aq)=H2O(l)△H=-53.7kJ•mol-1,若将含0.5 molH2SO4的稀硫酸与含0.5molBa(OH)2的溶液混合,放出的热量大于53.7kJ | |
| D. | 若化学平衡正向移动,则反应物的转化率会增大,平衡常数也必发生变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题

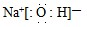 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com