
 含有同一元素的A、B、C、D、E五种物质有如图所示转化关系(反应条件已略去),判断它是各是什么物质,并写出指定转化的化学方程式.
含有同一元素的A、B、C、D、E五种物质有如图所示转化关系(反应条件已略去),判断它是各是什么物质,并写出指定转化的化学方程式.
| ||
| ||


 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:
| A | B | C | D | |
| 环境 |  |
 |
 |
 |
| 行为 | 切勿随意进入 | 严禁烟火 | 尽量远离 | 顺风向低处跑 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、过量的SO2通人NaOH溶液中:SO2+2OH-=SO32-+H2O |
| B、Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2 |
| C、碳酸氢钠溶液与足量氢氧化钡溶液混合:HCO3-+Ba2++OH-=BaCO3↓+H2O |
| D、少量金属钠加到冷水中:Na+2H2O=Na++OH-+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 180℃ |
| 催化剂 |
| CO2 |
| 反应Ⅰ |
| Na2SO3水溶液 |
| 反应Ⅱ |
| 浓度/mol?L-1/ 时间/min |
NO | N2 | CO2 |
| 0 | 0.100 | 0 | 0 |
| 10 | 0.058 | 0.021 | 0.021 |
| 20 | 0.040 | 0.030 | 0.030 |
| 30 | 0.040 | 0.030 | 0.030 |
| 40 | 0.032 | 0.034 | 0.017 |
| 50 | 0.032 | 0.034 | 0.017 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间t/min | 0 | 1 | 2 | 3 | 4 | 5 |
| 总压强P l00kPa | 4 | 4.6 | 5.4 | 5.8 | 6 | 6 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 3 |
| 73 |
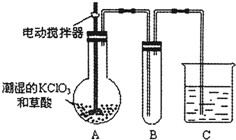
查看答案和解析>>
科目:高中化学 来源: 题型:
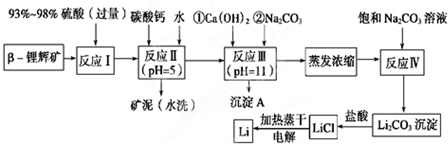
| 氢氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.7 | 9.6 |
| 完全沉淀pH | 3.7 | 4.7 | 11 |
| 温度/℃ | 0 | 10 | 20 | 50 | 75 | 100 |
| Li2CO3的溶解度/g | 1.539 | 1.406 | 1.329 | 1.181 | 0.866 | 0.728 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氨水与氯化铵的pH=7的混合溶液中:c(Cl-)>c(NH4+) |
| B、pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-) |
| C、pH=12的NaOH溶液与等体积pH=2的醋酸溶液混合后所得溶液显酸性 |
| D、将0.1mol/L的氨水溶液加水稀释10倍,溶液中离子浓度都减少 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com