
分析 a.用洁净铂丝蘸取溶液在无色火焰上灼烧,火焰呈黄色,则一定含Na+;
b.溶液中通入氯气,溶液由无色变为橙黄色,生成溴单质,则一定含Br-;
c.溶液中加入过量的稀硫酸后,无气体放出,再加Ba(OH)2溶液后,产生白色沉淀,可知一定不含CO32-,白色沉淀为硫酸钡,但加硫酸引入SO42-,不能确定原溶液中是否含SO42-,以此来解答.
解答 解:(1)由上述分析可知,一定存在的离子为Na+、Br-,一定不存在的离子是CO32-,故答案为:Na+、Br-;CO32-;
(2)只有c操作不合理,加硫酸引入硫酸根离子,干扰其检验,故答案为:c;SO42-;
(3)由上述分析可知,不能确定是否含金属离子为K+,为确定是否存在,应补充的操作是透过蓝色钴玻璃做焰色反应,故答案为:透过蓝色钴玻璃做焰色反应.
点评 本题考查常见离子的检验,为高频考点,把握离子之间的反应、现象与结论为解答的关键,侧重分析与实验能力的考查,注意硫酸根离子检验为易错点,题目难度不大.


科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 现象 | 解释或结论 |
| A | 用玻璃棒蘸取溶液X进行焰色反应实验 | 火焰呈黄色 | 溶液X中含有Na+ |
| B | 向装有Fe(NO3)2溶液的试管中加入稀H2SO4 | 在管口观察到红棕色气体 | HNO3分解成了NO2 |
| C | 在新生成的AgCl沉淀中滴入稀KI溶液,振荡 | 白色沉淀转化为黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| D | 向饱和碳酸钠溶液中通入过量的CO2 | 溶液变浑浊 | 析出了Na2CO3 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 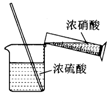 配制混酸 | B. | 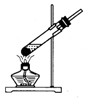 硝化反应 | C. |  分离硝基苯 | D. | 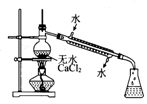 蒸馏硝基苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲烷的燃烧热△H=-890.3 kJ•mol-1,则甲烷燃烧的热化学方程式可表示为:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H=-890.3 kJ•mol-1 | |
| B. | 在25℃、101 kPa时,2gH2完全燃烧生成液态水,放出285.8 kJ热量,氢气燃烧的热化学方程式表示为2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1 | |
| C. | 一定条件下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-38.6 kJ•mol-1 | |
| D. | HCl和NaOH反应的中和热△H=-57.3 kJ•mol-1,则H2SO4和Ca(OH)2反应的中和热为△H=2×(-57.3)kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| X | Y |
| Z | W |
| A. | 1项 | B. | 2项 | C. | 3项 | D. | 4项 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NH3是10电子分子,呈三角锥型 | |
| B. | NH3极易溶于水,可做喷泉实验;氨气易液化,液氨可用作制冷剂 | |
| C. | 氨气是非电解质,氨水是电解质 | |
| D. | 沾有浓盐酸的玻璃棒遇氨气可产生白烟 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
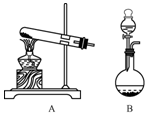 实验室制取氨气有几种方法.
实验室制取氨气有几种方法.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com