


科目:高中化学 来源: 题型:
| A、②⑤⑦ | B、①③⑥ |
| C、①③⑦ | D、④⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、宏观上的物质对外不显电性,是因为组成它们的微观粒子都是电中性的原子和分子 |
| B、某物质经科学测定只含有一种元素,则可以断定该物质是一种纯净物 |
| C、利用化学方法,我们可以制造出新的分子,但不能制造出新原子 |
| D、由两种元素组成的电解质分子中,显正价的是阳离子,显负价的是阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①② | B、③⑥ | C、②④ | D、③⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
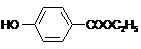 ,生产过程如下图:
,生产过程如下图:
 的分子式为
的分子式为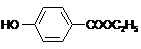 中的含氧官能团名称是
中的含氧官能团名称是 ,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,则-X的结构简式可能是
,-X、-Y为取代基)是对羟基苯甲酸乙酯的同分异构体且能发生银镜反应,则-X的结构简式可能是查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在其他条件不变的情况下,向饱和AgCl水溶液中加入NaCl溶液,Ksp(AgCl)不变 |
| B、浓度均为0.2 mol?L-1的AgNO3溶液和CH3COONa溶液等体积混合一定产生CH3COOAg沉淀 |
| C、c(Mg2+)为0.11 mol?L-1的溶液中要产生Mg(OH)2沉淀,溶液的pH要控制在9以上 |
| D、将0.001 mol?L-1的AgNO3溶液滴入0.001 mol?L-1的KCl和0.001 mol?L-1的K2CrO4溶液中,先产生Ag2CrO4沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验编号 | 起始浓度/(mol?L-1) | 反应后溶 液的pH | |
| c(HA) | c(KOH) | ||
| ① | 0.1 | 0.1 | 9 |
| ② | x | 0.2 | 7 |
| A、实验①反应后的溶液中:c(K+)>c(A-)>c(OH-)>c(H+) |
| B、实验①反应后的溶液中:c(OH-)=c(K+)-c(A-)=KW1X10-9mol?L-1 |
| C、实验②反应后的溶液中:c(A-)+c(HA)>0.1mol?L-1 |
| D、实验②反应后的溶液中:c(K+)=c(A-)>c(OH-)=c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、传统的氯化钠融雪剂通过升高水的凝固点实现雪融化 |
| B、尿素通过CO2与NH3发生化合反应制得 |
| C、融雪除冰剂在溶于水时具有较高的溶解热,极强的吸湿性,能降低水的熔点 |
| D、近来美国科技人员研制出一种新型的融雪除冰剂--醋酸镁钙,是一种混合物,溶于水时导致溶液呈酸性 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com