
莽草酸是合成治疗禽流感的药物——达菲的原料之一。莽草酸是A的一种异构体。A的结构式如下:
(1)A的分子式是
(2)A与溴的四氯化碳溶液反应的产物的结构简式是
(3)A与氢氧化钠反应的化学方程式(有机物用结构简式表示)是
(4)17.4 g A与足量碳酸氢钠溶液反应,生成二氧化碳的体积(标况下)为 L。
 作业辅导系列答案
作业辅导系列答案 同步学典一课多练系列答案
同步学典一课多练系列答案 经典密卷系列答案
经典密卷系列答案 金牌课堂练系列答案
金牌课堂练系列答案科目:高中化学 来源: 题型:
燃烧法是测定有机化合物化学式的一种重要方法。取0.1mol某烃完全燃烧,燃烧产物依次通过右下图所示的装置,实验结束后,称得甲装置增重5.4g,乙装置增重26.4g。
(1)(5分)求该烃的分子式
(2)(3分)该烃不能因化学反应使溴水和酸性KMnO4溶液褪色,
写出其二氯代物可能的结构简式
|
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质不能使酸性KMnO4溶液褪色的是( )
①乙烯; ②乙烷; ③乙苯; ④乙炔; ⑤二氧化硫; ⑥二甲苯
A.②③⑥ B.③⑥ C.②③⑤⑥ D.②
查看答案和解析>>
科目:高中化学 来源: 题型:
某有机物A是生产有机农药“杀螨灵”的一种中间体,其结构简式如下图。则下列叙述正确的是 ( )
A.有机物A属于芳香烃
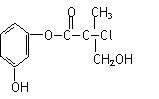 B.有机物A与 Br2的CCl4溶液容易发生加成反应
B.有机物A与 Br2的CCl4溶液容易发生加成反应
C.有机物A和浓硫酸混合加热,可以发生消去反应
D.1 mol A和足量的NaOH溶液反应,最多可以消耗4 mol NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
已知分解1 mol H2O2 放出热量98KJ,在含少量I-的溶液中,H2O2的分解机理为:
H2O2+ I- →H2O +IO- 慢 H2O2+ IO-→H2O +O2+ I- 快
下列有关反应的说法正确的是( )
A.反应的速率与I-的浓度有关 B. IO-也是该反应的催化剂
C.反应活化能等于98KJ·mol-1 D.v(H2O2)=v(H2O)=v(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
醇是重要的有机化工原料,可由乙烯直接水合法或间接水合法生产。回答下列问题:
(1)间接水合法是指先将乙烯与浓硫酸反应生成硫酸氢乙酯(C2H5OSO3H)。再水解生成乙醇。写出相应的反应的化学方程式
(2)已知:
甲醇脱水反应①2CH3OH(g)=CH3OCH3(g)+H2O(g)△H1=-23.9KJ·mol-1
甲醇制烯烃反应②2CH3OH(g)=C2H4 (g)+2H2O(g) △H2=-29.1KJ·mol-1
乙醇异构化反应③CH3CH2OH(g)=CH3OCH3(g)) △H3=+50.7KJ·mol-1
则乙烯气相直接水合反应C2H4 (g)+H2O(g)=C2H5OH(g)的△H= KJ·mol-1
与间接水合法相比,气相直接水合法的优点是: 。
(3)下图为气相直接水合法中乙烯的平衡转化率与温度、压强的关系(其中n(H2O)︰n(C2H4)=1︰1)
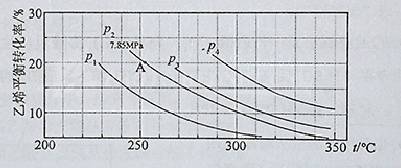
①列式计算乙烯水合制乙醇反应在图中A点的平衡常数K= (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)
②图中压强P1、P2、P3、P4的大小顺序为: ,理由是:
③气相直接水合法党采用的工艺条件为:磷酸/硅藻土为催化剂,反应温度290 ℃,压强6.9MPa,n(H2O)︰n(C2H4)=0.6︰1。乙烯的转化率为5℅。若要进一步提高乙烯的转化率,除了可以适当改变反应温度和压强外,还可以采取的措施有: 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关Fe2(SO4)3溶液的叙述正确的是
A.该溶液中K+、Fe2+、C6H5OH、Br-可以大量共存
B.和K
 I溶液反应的离子方程式:Fe3++2I-
I溶液反应的离子方程式:Fe3++2I- Fe2++I2
Fe2++I2
C.和Ba(OH)2溶液反应的离子方程式:Fe3++SO42—+Ba2++3OH- Fe(OH)3+ Ba SO4
Fe(OH)3+ Ba SO4
D.1 L0.1 mol·L—1该溶液和足量的Zn充分反应,生成11.2 g Fe
查看答案和解析>>
科目:高中化学 来源: 题型:
将V1 mL 1.00 mol·L-1 HCl溶液和V2 mL未知浓度的NaOH溶液混合均匀后测量并记录溶液温度,实验结果如图所示(实验中始终保持V1+V2=50 mL)。下列叙述正确的是( )
A.做该实验时环境温度为22 ℃
B.该实验可分多次把NaOH溶液倒入盛有硫酸的小烧杯中
C.NaOH溶液的浓度约为1.50 mol·L-1
D.该实验表明有水生成的反应都是放热反应

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com