
【题目】写出下列物质间转化的化学化学方程式,并注明反应条件.
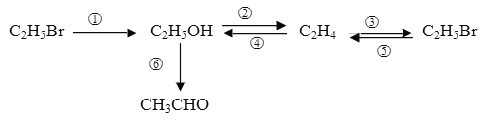
① ________________________________________________________ ;
② ________________________________________________________ ;
⑤ ________________________________________________________ ;
⑥ ________________________________________________________ 。
【答案】C2H5Br+NaOH ![]() C2H5OH+NaBr C2H5OH
C2H5OH+NaBr C2H5OH ![]() CH2=CH2↑+H2O C2H5Br+NaOH
CH2=CH2↑+H2O C2H5Br+NaOH ![]() CH2=CH2↑+H2O+NaBr 2C2H5OH+O2
CH2=CH2↑+H2O+NaBr 2C2H5OH+O2 ![]() 2CH3CHO+2H2O
2CH3CHO+2H2O
【解析】
①溴乙烷在碱性条件下水解,生成乙醇;②乙醇在浓硫酸做催化剂,170℃发生消去反应生成乙烯;③乙烯一定条件下与溴化氢加成生成溴乙烷;④乙烯一定条件下与水加成生成乙醇;⑤溴乙烷在强碱醇溶液作用下发生消去反应生成乙烯;⑥乙醇催化氧化生成乙醛。
①溴乙烷在碱性条件下水解,生成乙醇,方程式 C2H5Br+NaOH ![]() C2H5OH+NaBr;
C2H5OH+NaBr;
答案:C2H5Br+NaOH ![]() C2H5OH+NaBr
C2H5OH+NaBr
② 乙醇在浓硫酸做催化剂,170℃发生消去反应生成乙烯,方程式C2H5OH ![]() CH2=CH2↑+H2O;
CH2=CH2↑+H2O;
答案:C2H5OH ![]() CH2=CH2↑+H2O
CH2=CH2↑+H2O
⑤ 溴乙烷在强碱醇溶液作用下发生消去反应生成乙烯,方程式C2H5Br+NaOH ![]() CH2=CH2↑+H2O+NaBr;
CH2=CH2↑+H2O+NaBr;
答案:C2H5Br+NaOH ![]() CH2=CH2↑+H2O+NaBr
CH2=CH2↑+H2O+NaBr
⑥ 乙醇在铜或银做催化剂条件下,催化氧化生成乙醛, 2C2H5OH+O2 ![]() 2CH3CHO+2H2O 。
2CH3CHO+2H2O 。
答案:2C2H5OH+O2 ![]() 2CH3CHO+2H2O
2CH3CHO+2H2O


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】有下列反应:
①2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
②CaO+H2O=Ca(OH)2
③Ba(OH)2+H2SO4=BaSO4↓+2H2O
④Zn+2HCl=ZnCl2+H2↑
⑤2KClO3![]() 2KCl+3O2↑
2KCl+3O2↑
⑥CaCO3![]() CaO+CO2↑
CaO+CO2↑
⑦2CO+O2![]() 2CO2
2CO2
⑧SO42-+Ba2+=BaSO4↓
(1)既是分解反应又是氧化还原反应的是_____,既是化合反应又是氧化还原反应的是______(均填序号)。
(2)请用单向桥表示反应①的电子转移的方向和数目:________________。其中,该反应的氧化产物是___________,还原产物是__________。
(3)反应③的离子反应方程式为_________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常见元素及化合物的转化关系如图所示:
![]()
又知A~E中均含有一种相同元素。下列说法错误的是( )
A.物质A一定是单质B.物质C可能是淡黄色固体
C.物质D可能是酸或碱D.物质E可能属于盐类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表列出了①~⑨九种元素在周期表中的位置。
族 | ⅠA | 0 | ||||||
1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
2 | ② | ③ | ④ | ⑤ | ||||
3 | ⑥ | ⑦ | ⑧ | ⑨ | ||||
请按要求回答下列问题:
(1)①~⑨九种元素中非金属性最强的是________(填元素符号)。
(2)元素⑧的原子结构示意图是_________;由①、④、⑥三种元素组成的化合物,其电子式是_________。
(3)元素②、⑧的气态氢化物的稳定性较强的是________________(填化学式);元素③、⑨的最高价氧化物对应的水化物的酸性较强的是________________(填化学式)。
(4)③、④span>、⑧三种元素的原子半径由大到小的顺序是________________(填元素符号)。
(5)元素⑤、⑥组成的化合物的化学键类型是________________________。
(6)元素⑥的最高价氧化物对应的水化物与元素⑦的最高价氧化物对应的水化物反应的离子方程式是________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在催化剂作用下,氮氧化物与一氧化碳能发生反应,如:
![]()
![]()
![]() 反应Ⅰ
反应Ⅰ
(1)已知:![]()
![]() 反应Ⅱ
反应Ⅱ
![]()
![]() 反应Ⅲ
反应Ⅲ
①![]() __________(用含b、c的代数式表示)。
__________(用含b、c的代数式表示)。
②温度为![]() 时,CO与
时,CO与![]() 在密闭容器中发生反应Ⅲ,
在密闭容器中发生反应Ⅲ,![]() 的体积分数
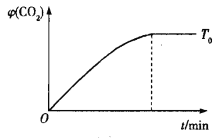
的体积分数![]() 随时间变化的关系如下图所示。请在坐标图中画出温度为
随时间变化的关系如下图所示。请在坐标图中画出温度为![]() 时,
时,![]() 随时间的变化曲线并进行相应的标注。_______
随时间的变化曲线并进行相应的标注。_______
(2)在恒压条件下,将NO和CO置于密闭容器中发生反应Ⅰ,在不同温度、不同投料比![]() 时,NO的平衡转化率见下表:
时,NO的平衡转化率见下表:
| 300K | 400K | 500K |
1 | 15% | 24% | 33% |
2 | 10% | 18% | 25% |
a__________(填“>”“<”或“=”)0,理由是_________。试判断反应Ⅰ在常温下能否自发进行并说明理由:___。
②下列措施有利于提高CO平衡转化率的是__________(填字母)。
A.升高温度同时增大压强
B.继续通入CO
C.加入高效催化剂
D.及时将![]() 从反应体系中移走
从反应体系中移走
③500 K时,将投料比为2的NO与CO混合气体共0.9 mol,充入一装有催化剂且体积为3 L的密闭容器中,5 min时反应达到平衡,则500 K时该反应的平衡常数K为__________(保留两位小数,下同);从反应开始到达到平衡时CO的平均反应速率为__________![]() 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼元素的单质和化合物很多,我们可以利用所学知识认识和理解它们。
(1)硼元素位于元素周期表的__________区;硼元素的价电子排布式为_________。
(2)B、C、Si与H、O原子形成的单键和B、C、Si原子自成单键的键能如下表所示:
化学键 |
|
|
|
|
|
|
|
|
|
键能 | 389 | 411 | 318 | 561 | 358 | 452 | 293 | 346 | 222 |
①自然界中硼主要以含氧化合物的形式存在的原因是_____________。
②类似于烷烃,B、Si也有一系列氢化物,但从物质数量角度看:硅烷<硼烷<烷烃。原因是_________。
③推测晶体B的晶体类型是__________。
(3)乙硼烷![]() 具有强还原性,它和氢化锂反应生成硼氢化锂
具有强还原性,它和氢化锂反应生成硼氢化锂![]() ,硼氢化锂常用于有机合成。
,硼氢化锂常用于有机合成。![]() 由
由![]() 和
和![]() 构成。
构成。![]() 中B原子的杂化轨道类型为_______;
中B原子的杂化轨道类型为_______;![]() 中三种元素电负性由大到小的顺序是__________(写元素符号)。
中三种元素电负性由大到小的顺序是__________(写元素符号)。
(4)氮化硼(BN)是一种重要的功能陶瓷材料。可通过下列反应得到:![]()
①□内物质的空间构型为__________。
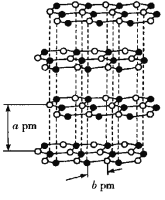
②在与石墨结构相似的六方氮化硼晶体中,晶体的层间距为a pm,![]() 键键长为b pm,则六方氮化硼晶体的密度为__________
键键长为b pm,则六方氮化硼晶体的密度为__________![]() (用
(用![]() 表示阿伏加德罗常数的值)。
表示阿伏加德罗常数的值)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验装置进行的相应实验,能达到实验目的的是
A.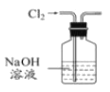 除去Cl2中含有的少量HCl
除去Cl2中含有的少量HCl
B.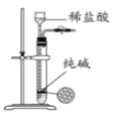 制取少量纯净的CO2气体
制取少量纯净的CO2气体
C.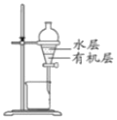 分离CC14萃取碘水后已分层的有机层和水层
分离CC14萃取碘水后已分层的有机层和水层
D.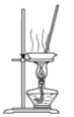 蒸干FeCl3饱和溶液制备FeCl3晶体
蒸干FeCl3饱和溶液制备FeCl3晶体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在画某种元素的一种单核微粒的结构的示意图时,忘记在圆圈内标出其质子数,请你根据下面的提示做出自己的判断.
![]()
(1)该微粒是中性微粒,这种微粒的符号是
(2)该微粒的还原性很弱,失去1个电子后变为原子,原子的氧化性很强,该单质与水反应的化学方程式:
(3)该微粒的还原性很弱,失去2个电子后变成原子,该元素在周期表中的位置为
(4))该微粒的氧化性很弱,得到1个电子后变为原子,原子的还原性很强,该单质与水反应的化学方程式 .
(5)该微粒的符号为X3﹣,则这种微粒的单质的电子式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关除杂质(括号中为杂质)的操作中,错误的是( )
A.乙醇(水):加入足量生石灰充分振荡,蒸馏,收集馏出物
B.![]() (乙醇):多次加水,振荡,分液,弃水层
(乙醇):多次加水,振荡,分液,弃水层
C.![]() (
(![]() ):通入足量的高锰酸钾溶液
):通入足量的高锰酸钾溶液
D.乙酸乙酯(乙酸):加饱和碳酸钠溶液,充分振荡,分液,弃水层
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com