
分析 A.常温下,pH=7的溶液中c(H+)=c(OH-),根据电荷守恒判断;
B.醋酸是弱电解质,稀释醋酸溶液时促进醋酸电离,除了氢氧根离子浓度外,其它离子浓度都减小;
C.混合液中醋酸过量,溶液呈酸性;
D.常温下,硫离子的第一步水解程度大于第二步,酸性越强,对应的酸根离子的水解程度越弱;
E.纯水中氢离子与氢氧根离子浓度相等,则溶液为中性;
F.醋酸为弱酸,加水稀释促进电离;
G.计算稀释后的氢离子浓度,可计算pH.
解答 解:A.常温下,pH=7的溶液中c(H+)=c(OH-),溶液中存在电荷守恒,所以c(Cl-)+c(OH-)=c(NH4+)+c(H+),所以c(Cl-)=c(NH4+),故A错误;
B.醋酸是弱电解质,稀释醋酸溶液时促进醋酸电离,醋酸根离子和氢离子浓度都减小,温度不变,水的离子积常数不变,所以氢氧根离子浓度增大,故B错误;
C.pH=3的醋酸溶液中,醋酸的浓度大于0.001mol/L,pH=11的氢氧化钠溶液的浓度为0.001mol/L,两溶液等体积混合后醋酸过量,溶液呈酸性,则溶液的pH<7,故C错误;
D.常温下,硫离子的第一步水解程度大于第二步,则H2S的酸性较强,所以同浓度的Na2S与NaHS溶液相比,Na2S的水解程度较大,其溶液的pH较大,故D正确;
E.95℃时水的电离程度增大,则纯水中氢离子浓度增大,纯水的pH<7,由于氢离子与氢氧根离子的浓度相等,则纯水呈中性,故E错误;
F.醋酸为弱酸,加水稀释促进电离,将pH=3的醋酸溶液稀释至10倍后溶液3<pH<4,故F错误;
G.将0.2mol•L-1的盐酸与等体积水混合后,c(H+)=0.1mol/L,则pH=1,故G正确;
故答案为:DG;
点评 本题考查较为综合,涉及弱电解质的电离以及pH的计算,为高频考点,题目难度中等,侧重于学生的分析和计算能力的考查,注意把握弱电解质的电离特点,试题培养了学生的分析能力及灵活应用能力.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:选择题
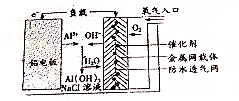
| A. | 电池的负极材料为附着有催化剂的金属网载体 | |
| B. | 电池负极的电极反应为2Cl-2e-═Cl2↑ | |
| C. | 铝电池的电极反应为Al-3e-═Al3+ | |
| D. | 正极的电极反应为O2+4H++4e-═2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 粒子 | 操作 | 现象 | 现象 | |
| a | H+ | |||
| b | Cl- | |||
| c | Cl2 | |||
| d | HClO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12△H3+5△H2-2△H1 | B. | 2△H1-5△H2-12△H3 | C. | 12△H3-5△H2-2△H1 | D. | △H1-5△H2-12△H3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有①③ | B. | 只有②③ | C. | ①②③④ | D. | 只有③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑤⑥ | B. | ②③④⑤ | C. | ①③④⑤ | D. | ①②⑤⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com