
分析 (1)根据n=$\frac{m}{M}$、c=$\frac{n}{V}$计算出该溶液中氯化钡的物质的量浓度;
(2)溶液具有均一性,则取出的溶液浓度不变;根据m=nM=cVM计算出含有溶质的质量;
(3)根据稀释过程中溶质的物质的量不变计算出所得溶液中钡离子、氯离子的浓度.
解答 解:(1)20.8g氯化钡的物质的量为:n(BaCl2)=$\frac{20.8g}{208g/mol}$=0.1mol,
该溶液中氯化钡的物质的量浓度为:c(BaCl2)=$\frac{0.1mol}{0.5L}$=0.2mol/L,
故答案为:0.2;
(2)若从中取出50mL,溶液的浓度不变,则其物质的量浓度为0.2mol/L;
该50mL溶液中含有氯化钡的质量为:m(BaCl2)=208g/mol×0.2mol/L×0.05L=2.08g,
故答案为:0.2;2.08;
(3)若将这50mL溶液用水稀释到100mL,稀释过程中溶质的物质的量不变,则所得溶液中Ba2+的物质的量浓度为:c(Ba2+)=$\frac{0.2mol×0.05L}{0.1L}$=0.1mol/L,Cl-的物质的量浓度为钡离子浓度的2倍,即:c(Cl-)=2c(Ba2+)=0.2mol/L,
故答案为:0.1;0.2.
点评 本题考查了物质的量浓度的计算,题目难度中等,明确物质的量浓度的概念及表达式为解答关键,注意熟练掌握物质的量与摩尔质量、物质的量浓度等物理量之间的关系,试题侧重基础知识的考查,培养了学生的化学计算能力.


科目:高中化学 来源: 题型:选择题
| A. | Na+ | B. | SO42- | C. | Ba2+ | D. | NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 601.17KJ | B. | 67.2KJ | C. | 534KJ | D. | 500.4KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 40mL 5mol/L的盐酸 | B. | 500mL 1mol/L的氯化钠溶液 | ||
| C. | 100mL 3mol/L的硫酸 | D. | 250mL 2mol/L的氢氧化钠溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaHSO4显强酸性,因此从组成上分类它应该属于酸 | |
| B. | 含Fe元素质量分数为70%的Fe2O3是纯净物 | |
| C. | CuSO4•5H2O是混合物 | |
| D. | 显碱性的物质一定为碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
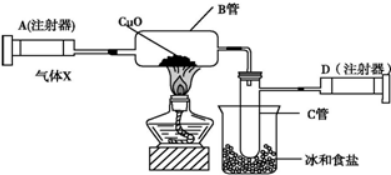
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示,A是直流电源的正极,C、D均为石墨电极,E、F均为铜电极.分别写出C、D、E、F四个电极的电极反应式.
如图所示,A是直流电源的正极,C、D均为石墨电极,E、F均为铜电极.分别写出C、D、E、F四个电极的电极反应式.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com