
分析 (1)设N2和H2的起始浓度分别为a mol•L-1、b mol•L-1,因为密闭容器容积为2L,则N2和H2的物质的量分别为2a mol、2b mol,由三行式分析,根据△n之比等于相应计量数之比列出比例式解题;
(2)平衡时N2的转化率是=$\frac{转化的氮气的物质的量}{氮气起始的物质的量}$×100%.
解答 解:(1)设N2和H2的起始浓度分别为a mol•L-1、b mol•L-1,因为密闭容器容积为2L,则N2和H2的物质的量分别为2a mol、2b mol,根据三行式分析求解:
N2 +3H2 $?_{催化剂}^{高温、高压}$ 2NH3
1 3 2
n(始) 2a 2b 0
△n 2a-0.6 2b-0.8 0.2
n(平) 0.6 0.8 0.2
根据△n之比等于相应计量数之比列出比例式:$\frac{2a-0.6}{2b-0.8}$=$\frac{1}{3}$,$\frac{2a-0.6}{0.2}$=$\frac{1}{2}$,$\frac{2b-0.8}{0.2}$=$\frac{3}{2}$,解得:a=0.35,b=0.55;
答:N2和H2的起始浓度分别为0.35mol•L-1、0.55mol•L-1;
(2)平衡时N2的转化率=$\frac{转化的氮气的物质的量}{氮气起始的物质的量}$×100%,转化的氮气的物质的量为(2a-0.6)mol,氮气起始的物质的量为2a,
则平衡时N2的转化率=$\frac{2a-0.6}{2a}$×100%=$\frac{2×0.35-0.6}{2×0.35}$×100%=14.3%,
答:N2的转化率为14.3%.
点评 本题考查了化学平衡中最常用的计算方法即三行式,再利用物质的量变化之比与相应化学计量数之比相等建立关系式求解,以及转化率计算,都是化学平衡中的基础知识,题目简单.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:解答题
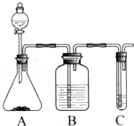 Ⅰ.实验室常用如图中的装置制备乙炔并检验乙炔的性质:
Ⅰ.实验室常用如图中的装置制备乙炔并检验乙炔的性质: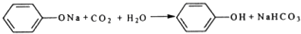 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
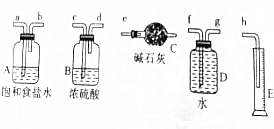
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 等于8.0g | B. | 等于8.00g | C. | 大于8.0g | D. | 等于0.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
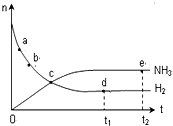 对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),在673K、30MPa下,n(NH3)和n(H2)随时间的变化关系如下图所示,下列说法正确的是( )
对于密闭容器中的反应:N2(g)+3H2(g)?2NH3(g),在673K、30MPa下,n(NH3)和n(H2)随时间的变化关系如下图所示,下列说法正确的是( )| A. | 点a的正反应速率比点b的大 | |
| B. | 点c处反应达到平衡 | |
| C. | 点d (t1时刻)和点e (t2时刻)处n(N2)不一样 | |
| D. | 若开始充入1mol N2及足量H2,提供适当条件,可得2mol NH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 某研究性学习小组设计了一组实验验证元素周期律.
某研究性学习小组设计了一组实验验证元素周期律.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | A | |||||||
| 2 | D | E | G | |||||
| 3 | B | C | J | F | H | I |
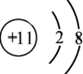 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com