
【题目】用MnO2氧化密度为1.19g·cm-3、溶质质量分数为36.5%的HCl溶液。反应方程式如下:MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O。
MnCl2+Cl2↑+2H2O。
(1)写出该反应的离子方程式______________________________。
(2)该反应的氧化剂为_____________,氧化产物是___________。
(3)17.4gMnO2能与_____摩尔HCl发生上述反应?有______摩尔HCl被氧化?
(4)若在标准状况下产生4.48L Cl2,则反应中转移电子_______摩尔。
【答案】MnO2+4H++4Cl-![]() Mn2++Cl2↑+2H2O MnO2 Cl2 0.8 0.4 0.4
Mn2++Cl2↑+2H2O MnO2 Cl2 0.8 0.4 0.4
【解析】
(1)根据化学方程式书写离子方程式;
(2)得到电子的物质是氧化剂,还原剂中失去电子的元素被氧化得到氧化产物;
(3)根据n=m/M计算二氧化锰的物质的量,结合方程式计算;
(4)得到1分子氯气,转移2个电子,据此解答。
(1)反应的化学方程式为MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,则该反应的离子方程式为MnO2+4H++4Cl-
MnCl2+Cl2↑+2H2O,则该反应的离子方程式为MnO2+4H++4Cl-![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(2)Mn元素化合价降低,得到电子,则该反应的氧化剂为MnO2。氯元素化合价升高,失去电子,HCl是还原剂,因此氧化产物是Cl2。
(3)17.4gMnO2的物质的量是17.4g÷87g/mol=0.2mol,根据方程式可知能与0.2mol×4=0.8molHCl发生上述反应,其中被氧化的HCl是参加反应的HCl的一半,即被氧化的HCl为0.4mol。
(4)标准状况下4.48LCl2的物质的量是4.48L÷22.4L/mol=0.2mol,反应中氯元素化合价从-1价升高到0价,即得到1分子氯气,转移2个电子,则反应中转移电子的物质的量是0.2mol×2=0.4mol。


科目:高中化学 来源: 题型:
【题目】Ba(NO3)2常用于军事上生产绿色信号弹、曳光弹等。某生产BaCO3的化工厂生产排出大量的钡泥(主要含有BaCO3、BaSO3、Ba(FeO2)2等,该厂利用钡泥制取Ba(NO3)2晶体(不含结晶水),部分工艺流程如下:
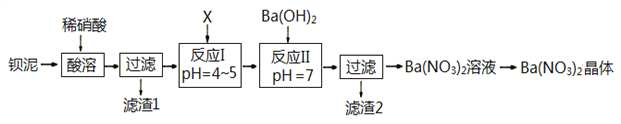
已知:pH=3.2时,可使Fe3+沉淀完全;
请回答下列问题:
(1)该厂生产的BaCO3因含有少量BaSO4而不纯,提纯的方法是:将产品加入足量的饱和Na2CO3溶液中,充分搅拌、过滤、洗涤。试用离子方程式说明提纯原理:______________________________。
(2)酸溶时,Ba(FeO2)2与HNO3反应的化学方程式为_______________________________。
(3)该厂结合本厂实际,化合物X最好选用_________
A.BaCl2 B.Ba(OH)2 C.Ba(NO3)2 D.BaCO3
(4)滤渣1和滤渣2洗涤产生的废液不能直接排入环境,原因是_______________________。
(5)①反应I需调节溶液pH值范围在4~5,目的是________________________________。
②验证该步骤中沉淀已完全的实验操作是_____________________________________。
(6)测定所得Ba(NO3)2晶体的纯度:准确称取w克晶体溶于蒸馏水,加入足量的硫酸,充分反应后,过滤、洗涤、干燥,称量其质量为m克,则该晶体的纯度为_____________。(提示:M(Ba(NO3)2)= 261 g/mol,M(BaSO4)= 233 g/mol)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于细胞主要化学成分的叙述,不正确的是( )
A. 蛋白质的多样性与氨基酸的种类、数目、排列顺序和氨基酸的空间结构密切相关
B. 若甲硫氨酸的R基是-CH2-CH2-S-CH3,则它的分子式是C5H11O2NS
C. 脱氧核糖核酸是染色体的主要成分之-
D. 胆固醇、性激素、维生素D都属于脂质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下浓度均为0.1mol/L 的四种盐溶液,其pH 如表所示,下列说法正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | CH3COONa | NaHCO3 | Na2CO3 | NaClO |
pH | 8.8 | 9.7 | 11.6 | 10.3 |
A. 将等浓度的CH3COOH 和HClO溶液,pH小的是HClO
B. Na2CO3和NaHCO3溶液中粒子种类不同
C. 溶液水的电离程度:①>②>④>③
D. NaHCO3溶液中:c (Na+) =c (CO32- )+c (HCO3- )+c (H2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,甲池的总反应式为:N2H4+O2=N2+H2O,下列关于该电池工作时的说法正确的是( )
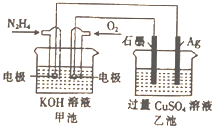
A. 该装置工作时,Ag电极上有气体生成
B. 甲池中负极反应为N2H4-4e-=N2+4H+
C. 甲池和乙池中的溶液的pH均减小
D. 当甲池中消耗0.1molN2H4时,乙池中理论上最多产生6.4g固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列做法正确的是( )
A.饮用牛奶和豆浆可以缓解重金属引起的中毒
B.二氧化硅用于制造太阳能电池
C.氨气泄漏时,用湿毛巾捂住口鼻,并尽量向高处去
D.用医疗垃圾中的废塑料生产一次性水杯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学兴趣小组为研究氯气的性质并模拟工业制备漂白粉,设计了下列装置进行实验。已知:
①A 中反应为 KClO3+6HCl(浓) = KCl+3Cl2↑+3H2O;
②石灰乳的主要成分为 Ca(OH)2,其他杂质不参与反应。
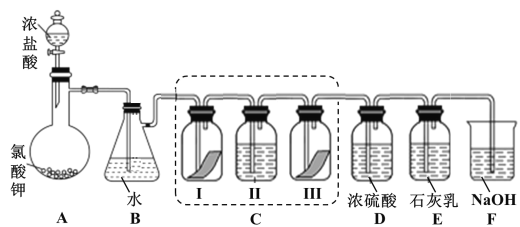
(1)写出 B 装置中反应的化学方程式_______________。实验结束后,立即将 B 中溶液滴几滴在紫色石蕊试纸上,可观察到的现象是______________
(2)装置 C 的实验目的是验证氯气是否具有漂白性,为此 C 中 I、II、III 处依次放入的物质正确的是_________(填编号)。
编号 | I | II | III |
A | 干燥的有色布条 | 碱石灰 | 湿润的有色布条 |
B | 干燥的有色布条 | 浓硫酸 | 湿润的有色布条 |
C | 湿润的有色布条 | 浓硫酸 | 干燥的有色布条 |
D | 湿润的有色布条 | 碱石灰 | 干燥的有色布条 |
(3)待 E 中物质完全反应后,经过一系列加工处理,得到漂白粉样品,其主要成份为_________、____________(填化学式)。
(4)F 装置的作用是(用离子方程式表示)_____________
(5)为测定(3)中所得漂白粉的有效成份含量。称取 a g 漂白粉样品溶解,往所得溶液中通入 CO2 至不再产生沉淀为止,该过程的化学方程式为_____________。若反应生成沉淀的物质的量为 b mol,则该漂白粉中有效成份的质量分数为_________________(用含 a、b 的式子表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com