化工行业的发展必须符合国家节能减排的总体要求.如图是煤化工产业链的一部分,试运用所学知识,解决下列问题:
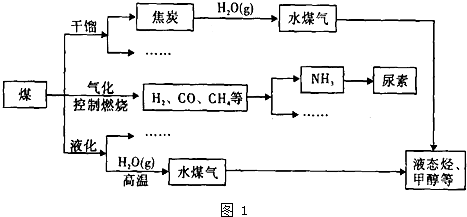
(1)如图中有一个反应是德国化学家哈伯进行过的实验,农业生产是该反应最大的应用领域.该反应的△H<O,则该反应的△S
0(填“>”或“<”)
(2)已知在一定温度下,以下三个反应的平衡常数为K
1、K
2、K
3①C(s)+CO
2(g)?2CO(g) K
1;
②CO(g)+H
2O(g)?H
2(g)+CO
2(g) K
2;
③C(s)+H
2O(g)?CO(g)+H
2(g)K
3;
则K
1、K
2、K
3之间的关系是
.
(3)二甲醚是一种重要的清洁燃料,工业上可利用煤的气化产物(水煤气)合成二甲醚.利用水煤气合成=甲醚的热化学方程式为:3H
2(g)+3CO(g)?CH
3OCH
3(g)+CO
2(g)△H=-274kJ?mol
-1①该反应在一定条件下的密闭容器中达到平衡后,为同时提高反应速率和二甲醚的产率,可以采取的措施是
(填字母代号).
a.降低温度 b.缩小容器体积 c.加入催化剂 d.增加H
2的浓度e.分离出二甲醚
②已知:CO(g)+H
2O(g)=CO
2(g)+H
2(g)△H=-42kJ?mol
-1某些化学键的键能数据如下表
| 化学键 | C-H | H-O | H-H | C-O | C=O |
| 键能/KJ mol-1 | 413 | 463 | 436 | 358 | 802 |
CO中的C与O之间为叁键连接,则CO中碳氧叁键的键能是
kJ?mol
-1.
(4)二甲醚也可以通过CH
3OH分子间脱水制得
2CH
3OH(g)?CH
3OCH
3(g)+H
2O(g)△H=-23.5kJ?mol
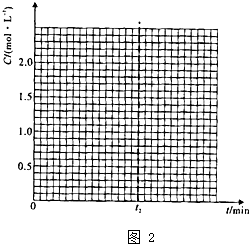
-1已知在280℃,体积不变的密闭容器中进行上述反应,t2时达到平衡,各组分起始和平衡浓度见下表.
| CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 起始浓度/mol?L-1 | 2.00 | 0.50 | 0 |
| 平衡浓度/mol?L-1 | c1 | 1.00 | c2 |
①表中c
1=
.在t
2min内平均反应速率v(H
2O)=
.
②若在400℃,相同的密闭容器中进行上述反应,请在F图中画出CH
3OCH
3浓度随时问变化的关系图.


 CO中的C与O之间为叁键连接,则CO中碳氧叁键的键能是
CO中的C与O之间为叁键连接,则CO中碳氧叁键的键能是 ,故答案为:
,故答案为: .
.


 名师金手指领衔课时系列答案
名师金手指领衔课时系列答案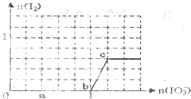 已知:还原性还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法正确的是( )
已知:还原性还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法正确的是( )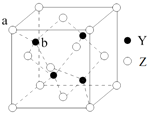 元素X是地壳中含量最多的元素;元素Y基态原子的3p 轨道上有4个电子;元素Z 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.
元素X是地壳中含量最多的元素;元素Y基态原子的3p 轨道上有4个电子;元素Z 位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.