
| A. | 碳与浓硝酸 | B. | 铜与稀硝酸 | ||
| C. | 二氧化锰与浓盐酸 | D. | 铝与稀盐酸 |
分析 A.木炭与浓硝酸反应:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O;
B.铜与稀硝酸反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O;
C.二氧化锰与浓盐酸为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O
D.Al和稀盐酸的反应:2Al+6HCl=2AlCl3+3H2↑;
假设都生成1mol气体,根据消耗酸的量判断.
解答 解:假设都生成1mol气体,
A.生成1mol气体,根据木炭与浓硝酸反应:C+4HNO3(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2↑+4NO2↑+2H2O知,消耗酸的物质的量=$\frac{1mol}{5}×4$=0.8mol;
B.生成1mol气体,根据铜与稀硝酸反应:3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O知,消耗酸的物质的量=$\frac{1mol}{2}×8$=4mol;
C.生成1mol气体,根据二氧化锰与浓盐酸为:MnO2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$MnCl2+Cl2↑+2H2O知,消耗酸的物质的量=4mol;
D.生成1mol气体,根据Al和稀盐酸的反应:2Al+6HCl=2AlCl3+3H2↑知,消耗酸的物质的量=$\frac{1mol}{3}×6$=2mol;
所以消耗酸的物质的量大小顺序是B=C>D>A,则消耗酸最少的是A,故选A.
点评 本题考查物质之间的反应,正确书写方程式并找出物质之间的关系式是解本题关键,侧重考查学生分析及计算能力,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | HCl和H2SO4都属于酸 | B. | K2CO3和K2O都属于盐 | ||
| C. | NaOH和Na2CO3都属于碱 | D. | H2O和O2都属于氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
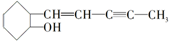 是我国科学家最近新合成的一种药物,下列关于该有机物的说法错误的是( )
是我国科学家最近新合成的一种药物,下列关于该有机物的说法错误的是( )| A. | 该有机物的分子式为C11H16O | |
| B. | 该有机物可以使溴水褪色 | |
| C. | 该有机物易溶于水 | |
| D. | 光照,该有机物可以与氯气发生取代反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Y、Z、R元素简单离子的半径依次增大 | |
| B. | 含有Y、Z、R三种元素的化合物最多只有2种 | |
| C. | 元素W和R最高价氧化物对应水化物的酸性后者强 | |
| D. | Y与Z形成的两种化合物中的化学键类型和阴阳离子个数比均相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
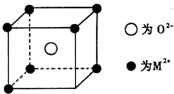 已知MO与CsCl的结构相似(如图2所示),MO晶体的密度为p g•cm-3,NA为阿伏加德罗常数,相邻的两个M2+的核间距为acm.写出Cs基态原子的价电子排布式6s1,MO的相对分子质量可以表示为ρa3 NA.
已知MO与CsCl的结构相似(如图2所示),MO晶体的密度为p g•cm-3,NA为阿伏加德罗常数,相邻的两个M2+的核间距为acm.写出Cs基态原子的价电子排布式6s1,MO的相对分子质量可以表示为ρa3 NA.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
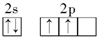 b.
b.
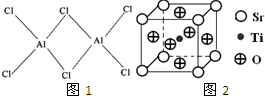
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
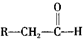 ,化学式为C8H8O2的有机物有如下的转化关系:
,化学式为C8H8O2的有机物有如下的转化关系: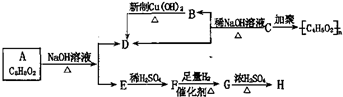
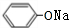 ,BCH3CHO.
,BCH3CHO.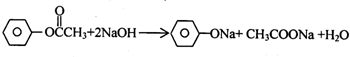 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com