
分析 原电池中,负极上失电子发生氧化反应,正极上得电子发生还原反应,该反应中Fe元素化合价由0价、+3价变为+2价,则Fe是负极,负极上Fe失电子生成亚铁离子,正极上铁离子得电子生成亚铁离子.
解答 解:原电池中,负极上失电子发生氧化反应,正极上得电子发生还原反应,该反应中Fe元素化合价由0价、+3价变为+2价,则Fe是负极,
(1)Fe是负极,电极反应式为Fe-2e═Fe2+,故答案为:Fe;Fe-2e═Fe2+;
(2)正极材料为不如Fe活泼的金属或导电的非金属,如Cu等,正极反应式为2Fe3++2e═2Fe2+,故答案为:Cu等;2Fe3++2e═2Fe2+.
点评 本题考查原电池设计,为高频考点,明确正负极发生反应与元素化合价变化关系是解本题关键,难点是判断电解质溶液,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | SO2和NO2都是有用的化工原料,因此目前都是将汽车尾气中的氮氧化合物收集后制备硝酸以防止污染空气 | |
| B. | 由于HClO具有漂白性,因此工业上常用Cl2的水溶液来漂白纸浆、毛、丝、草帽辫 | |
| C. | 稀土元素在自然界中含量非常低,难以开采,但它们在冶金工业中有着重要的用途,被称为冶金工业的维生素 | |
| D. | 金属钠通常被保存在煤油或石蜡油中,以隔绝空气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | W的原子序数可能是Y的两倍 | |
| B. | Z的原子半径比X的大 | |
| C. | Y元素的非金属性比Z元素的强 | |
| D. | Z的最高价氧化物对应的水化物的酸性比W的强 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
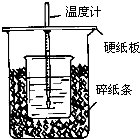 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
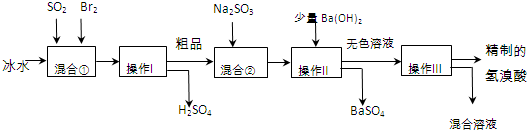
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com