
【题目】为了证明一水合氨是弱电解质,甲、乙、丙三位同学利用下面试剂进行实验:
0.10 mol·L-1氨水、NH4Cl晶体、醋酸铵晶体、酚酞试剂、pH试纸、蒸馏水。
(1)常温下,pH=10的氨水中,c(OH-)=___,由水电离出来的浓度为c(OH-)水=_____。
(2)甲用pH试纸测出0.10 mol·L-1氨水的pH为10,据此他认定一水合氨是弱电解质,你认为这一结论______(填“正确”或“不正确”),并说明理由__________________。
(3)乙取出10 mL 0.10 mol·L-1氨水,滴入2滴酚酞试液,显粉红色,原因是(用电离方程式回答):______;再加入CH3COONH4晶体少量,颜色变浅,原因是:__________。你认为这一方法能否证明一水合氨是弱电解质:_____(填“能”或“否”)。
(4)丙取出10 mL 0.10 mol·L-1氨水,用pH试纸测出其pH为a,然后用蒸馏水稀释至1 000 mL,再用pH试纸测出其pH为b,他认为只要a、b满足如下关系__________(用等式或不等式表示)就可以确认一水合氨是弱电解质。
【答案】10-4mol·L-1 10-10mol·L-1 正确 若是强电解质,则0.010 mol·L-1氨水溶液中c(OH-)应为0.010 mol·L-1,pH=12 NH3·H2ONH![]() +OH- 加入CH3COONH4晶体,NH
+OH- 加入CH3COONH4晶体,NH![]() 浓度增大,氨水的电离平衡左移,溶液中c(OH-)减小 能 a-2<b<a
浓度增大,氨水的电离平衡左移,溶液中c(OH-)减小 能 a-2<b<a
【解析】
(1)常温下,pH=10的氨水中,c(H+)=10-10mol/L,c(OH-)=![]() =10-4mol·L-1,氨水中氢离子全部由水电离,水电离出的氢氧根和氢离子浓度相等,所以c(OH-)水=10-10mol·L-1;
=10-4mol·L-1,氨水中氢离子全部由水电离,水电离出的氢氧根和氢离子浓度相等,所以c(OH-)水=10-10mol·L-1;
(2)若是强电解质,则0.010 mol·L-1氨水溶液中c(OH-)应为0.010 mol·L-1,pH=12,而实际上pH=10,说明一水合氨不完全电离,为弱电解质,故正确;
(3)滴入酚酞显红色,说明显碱性,一水合氨可以电离出氢氧根使溶液显碱性,电离方程式为NH3·H2ONH![]() + OH-;加入CH3COONH4晶体,NH
+ OH-;加入CH3COONH4晶体,NH![]() 浓度增大,氨水的电离平衡左移,溶液中c(OH-)减小,碱性减弱颜色变浅;该实验说明一水合氨溶液中存在电离平衡,能说明一水合氨是弱电解质;
浓度增大,氨水的电离平衡左移,溶液中c(OH-)减小,碱性减弱颜色变浅;该实验说明一水合氨溶液中存在电离平衡,能说明一水合氨是弱电解质;
(4)若一水合氨是弱电解质,加水稀释促进其电离,则由10mL稀释到1000mL后其pH会变小,且变化小于2,即a、b满足a-2<b<a,就可以确认一水合氨是弱电解质。


科目:高中化学 来源: 题型:
【题目】镁稀土合金广泛应用于航空、航天、电子、通讯和汽车制造业等领域。熔盐电解法是一种高效制备镁稀土合金的方法,实验室制取Mg-Gd合金(物质的量比为1:1)的电解槽示意图如下(相对原子质量Mg—24,Gd—157),下列说法正确的是

A.添加LiF、BaF2的作用是催化剂
B.阳极的电极反应式为2F——2e—= F2 ↑
C.当电路中通过0.1mol电子时,生成Mg- Gd合金的质量为3.62 g
D.电解结束后,铝、碳电极质量不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4molA气体和2molB气体充入到1L的密闭容器中,在一定条件下发生如下反应:2A(g)+ B(g)2C(g)。经2s后达到平衡时,测得C的物质的量为1.2 mol。下列说法中正确的是
A.平衡时,A物质的浓度为2.8 mol·L-1
B.平衡时,B的转化率为70%
C.反应后混合气体的总物质的量为5.2mol
D.用C表示平均反应速率为1.2mol·L-1·s-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒容密闭容器中发生反应:SiO2(s)+4HF(g)![]() SiF4(g)+2H2O(g)+148.9 kJ。叙述错误的是
SiF4(g)+2H2O(g)+148.9 kJ。叙述错误的是
A. 反应物的总能量高于生成物的总能量
B. 若生成2mol液态水,则放出的热量大于148.9 kJ
C. 当v正(HF)=2v逆(H2O)时,反应达到平衡状态
D. 平衡后放出的热量随加入SiO2量的增加而增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮类化合物在人类的日常生活中有着重要的作用。
(1)研究表明,在200℃,压强超过200MPa时,不使用催化剂,氨便可以顺利合成。但工业上合成NH3往往在温度500℃压强20~50MPa的条件下进行,已知合成氨为放热反应,试分析原因_____________。
(2)工业上常利用4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g)生产硝酸。在同温条件下,向2L的反应容器中充入2mol NH3与2.75molO2,平衡时NH3转化率为50%,则该温度下K=___;保持温度不变,增大压强,则平衡常数_____(填“增大”、“减小”或“不变”);其他条件不变,下列措施一定可以增大氨气转化率的是____。
4NO(g)+6H2O(g)生产硝酸。在同温条件下,向2L的反应容器中充入2mol NH3与2.75molO2,平衡时NH3转化率为50%,则该温度下K=___;保持温度不变,增大压强,则平衡常数_____(填“增大”、“减小”或“不变”);其他条件不变,下列措施一定可以增大氨气转化率的是____。
A.降低氨气浓度 B.增大容器体积 C.降低温度 D.移除水蒸气 E.选择合适的催化剂
(3)已知:A.2NH3(g)+CO2(g)NH2COONH4(l) ΔH=-123kJ/mol
B.NH2COONH4(l)(NH2)2CO(g)+H2O(g) ΔH= +50kJ/mol
①在工业生产中,尿素是由以上A、B两步合成的,则工业上由氨气与二氧化碳合成尿素的热化学反应方程式为:_______________。
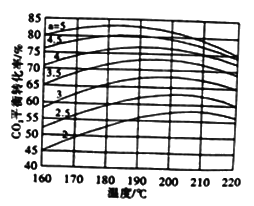
②尿素合成过程中通过控制温度、NH3和CO2的物质的量比(氨碳比a)等因素来提高CO2的转化率。如图是在其他因素一定,不同氨碳比条件下CO2平衡转化率与温度的关系图。由图可知当温度一定时,a值越大,CO2转化率越大其原因是______;当a一定时,CO2平衡转化率呈现先增大后减小的趋势,其原因为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g)![]() 2SO3(g) ΔH<0。下列说法正确的是( )
2SO3(g) ΔH<0。下列说法正确的是( )
A.达到平衡后,升高温度平衡正向移动B.达到平衡时:v(O2)=2v(SO2)
C.达到平衡后,降低温度O2的浓度将减小D.升高温度,正反应速率增加,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Fe2O3俗称氧化铁红,常用作油漆等着色剂。某实验小组用部分氧化的FeSO4为原料,以萃取剂X(甲基异丁基甲酮)萃取法制取高纯氧化铁并进行铁含量的测定。实验过程中的主要操作步骤如图1。
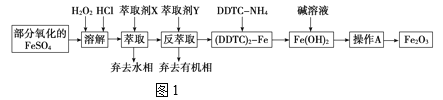
已知:①在较高的盐酸浓度下,Fe3+能溶解于甲基异丁基甲酮,当盐酸浓度降低时,该化合物解离;
②3DDTCNH4+Fe3+===(DDTC)3Fe↓+3NH4+。
请回答下列问题:
(1)用萃取剂X萃取的步骤中,以下关于萃取分液操作的叙述中,正确的是______________。

A.FeSO4原料中含有的Ca2+、Cu2+等杂质离子几乎都在水相中
B.为提高萃取率和产品产量,实验时分多次萃取并合并萃取液
C.溶液中加入X,转移至分液漏斗中,塞上玻璃塞,如图2用力振摇
D.振摇几次后需打开分液漏斗上口的玻璃塞放气
(2)下列试剂中,可作反萃取的萃取剂Y最佳选择是________。
A.高纯水 B.盐酸 C.稀硫酸 D.酒精
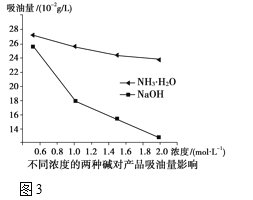
(3)吸油量是反映氧化铁红表面性质的重要指标。吸油量大,说明氧化铁红表面积较大,则用在油漆中会造成油漆假稠,影响质量。不同浓度的两种碱溶液对产物吸油量影响如图3所示,则上述实验过程中选用的碱溶液为_______________(填“NaOH”或“NH3·H2O”),反应的化学方程式为__________。
(4)操作A的步骤包括___________________________________________。
(5)现准确称取4.000 g样品,经酸溶、还原为Fe2+,在容量瓶中配成100 mL溶液,用移液管移取25.00 mL溶液于锥形瓶中,用0.100 0 mol/L的K2Cr2O7溶液进行滴定(还原产物是Cr3+),消耗K2Cr2O7溶液20.80 mL。
①用移液管从容量瓶中吸取25.00 mL溶液后,把溶液转移到锥形瓶中的具体操作为______________
②产品中铁的含量为___________(假设杂质不与K2Cr2O7反应)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源是当今社会发展的三大支柱之一.根据题中提供的信息,请回答下列问题:
I.天然气和甲醇都是一种高效、低耗、污染小的清洁能源。在一定条件下,通过太阳光的作用,形成如图所示的物质循环。
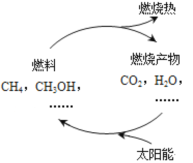
(1)写出甲烷完全燃烧的化学方程式________
(2)如图的物质循环中太阳能最终转化为_________能。
II.新冠疫情防控期间,测温枪发挥了极大的作用。有一种便携式测温枪,里面使用了锌银纽扣式电池,其电极材料分别为Zn和Ag2O,电解质为KOH溶液。工作时电池总反应为:Zn+ Ag2O+H2O=2Ag+ Zn(OH)2
(3)正极的电极反应式为___________
(4)外电路每通过0.4 mole-,负极质量增重了______ g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应CO(g)+H2O(g) ![]() CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
CO2(g)+H2(g) ΔH<0,在其他条件不变的情况下
A. 加入催化剂,改变了反应的途径,反应的ΔH也随之改变
B. 增大压强,正逆反应的化学反应速率都减小
C. 升高温度, 正反应化学反应速率增大, 逆反应化学反应速率减小
D. 对该反应来说,无论反应进行到何时,混合气体的总物质的量不变
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com