
【题目】Bodensteins研究反应H2(g)+I2(g)![]() 2HI(g) △H<0 ,温度为T时,在两个体积均为1L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表:
2HI(g) △H<0 ,温度为T时,在两个体积均为1L的密闭容器中进行实验,测得气体混合物中碘化氢的物质的量分数w(HI)与反应时间t的关系如下表:
容器编号 | 起始物质 | t/min | 0 | 20 | 40 | 60 | 80 | 100 |
Ⅰ | 0.5molI2、0.5molH2 | w(HI)/% | 0 | 50 | 68 | 76 | 80 | 80 |
Ⅱ | xmolHI | w(HI)/% | 100 | 91 | 84 | 81 | 80 | 80 |
研究发现上述反应中:v正=kaw(H2)w(I2),v逆=kbw2(HI),其中ka、kb为常数。下列说法不正确的是( )
A. 温度为T时,该反应![]() =64
=64
B. 容器I中在前20min的平均速率v(HI)=0.025molL-1min-1
C. 若起始时,向容器I中加入物质的量均为0.1mol的H2、I2、HI,反应逆向进行
D. 无论x为何值,两容器中达平衡时w(HI)%均相同
【答案】C
【解析】
A. H2(g)+I2(g)2HI(g)
起始量(mol/L) 0.5 0.5 0
变化量(mol/L) n n 2n
平衡量(mol/L) 0.5-n 0.5-n 2n
w(HI)/%=![]() ×100%=80%,n=0.4 mol/L,平衡常数 K=
×100%=80%,n=0.4 mol/L,平衡常数 K=![]() =64。反应达到平衡状态时正逆反应速率相等,kaw(H2)w(I2)=v正=v逆=kbw2(HI),则
=64。反应达到平衡状态时正逆反应速率相等,kaw(H2)w(I2)=v正=v逆=kbw2(HI),则![]() =
=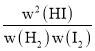 =K=64,故A正确;
=K=64,故A正确;
B.前20 min,H2(g) + I2(g)2HI(g)
起始量(mol/L) 0.5 0.5 0
变化量(mol/L) m m 2m
平衡量(mol/L) 0.5-m 0.5-m 2m
w(HI)%=![]() ×100%=50%,m=0.25mol/L,容器I中前20 min的平均速率,v(HI)=
×100%=50%,m=0.25mol/L,容器I中前20 min的平均速率,v(HI)=![]() =0.025molL-1min-1,故B正确;
=0.025molL-1min-1,故B正确;
C.若起始时,向容器I中加入物质的量均为0.l mol的H2、I2、HI,此时浓度商Qc=![]() =1<K=64,反应正向进行,故C错误;
=1<K=64,反应正向进行,故C错误;
D.H2(g)+I2(g)2HI(g)反应前后气体的物质的量不变,改变压强,平衡不移动,因此无论x为何值,Ⅰ和Ⅱ均等效,两容器达平衡时w(HI)%均相同,故D正确;
答案选C。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡CH3COOH![]() H++CH3COO-,不正确的是( )
H++CH3COO-,不正确的是( )
A. 醋酸溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B. 常温下0.10mol/L的CH3COOH溶液中加水稀释,溶液中c(OH-)减小
C. CH3COOH溶液中加少量的CH3COONa固体,平衡逆向移动
D. 常温下pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2008年质检部门在众多品牌乳制品中检出有毒有机物三聚氰胺[C3N3(NH2)3],在乳制品行业掀起了一场轩然大波,引发了一场关于食品安全问题的大讨论。三聚氰胺是一种重要的有机化工原料,因其含氮量高而被不法商家用作食品添加剂,以提升食品检测中的蛋白质含量指标(N%),因此三聚氰胺也被人称为“蛋白精”。三聚氰胺遇强酸或强碱水溶液水解,胺基逐步被羟基取代,最后生成三聚氰酸[C3N3(OH)3]。三聚氰酸可用于消除汽车尾气中的NO2。其反应原理为:![]() ;
;![]() ,下列说法正确的是( )
,下列说法正确的是( )
A. C3N3(OH)3与HNCO为同一物质B. HNCO是一种很强的氧化剂
C. 1mol NO2在反应中转移的电子为4molD. 反应中NO2是还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】写出下列反应的化学方程式:
(1)苯酚钠溶液中通少量的CO2 :______。
(2)由甲苯制TNT :_____________。
(3)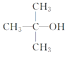 的消去反应:________。
的消去反应:________。
(4)![]() 的水解反应:______。
的水解反应:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列十种物质:①O2 ②铝 ③Na2O ④CO2 ⑤H2SO4 ⑥Ba(OH)2 ⑦红褐色的氢氧化铁液体 ⑧氨水 ⑨盐酸 ⑩CaCO3
(1)按物质的树状分类法填写表格的空白处:
_________ | 氧化物 | _________ | _________ | 电解质 | |
属于该类的物质 | ② | _________ | ⑧ ⑨ | ⑦ | _________ |
(2)写出实验室制备①的化学方程式:____________________。
(3)上述十种物质中,有两种物质之间可发生H++OH-=H2O,该离子反应对应的化学方程式为_________________。
(4)写出制备⑦的化学方程式:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】18.0 mol·L-1的浓硫酸稀释成2.00 mol·L-1的稀硫 酸100 ml,实验操作如下:
(1)计算并用量筒量取 ml的18.0 mol·L-1的浓硫酸;
(2)将 沿烧杯内壁慢慢注入盛有少量 的烧杯中;
(3)将已冷却至室温的硫酸溶液沿玻璃棒注入 ___________;
(4)用少量蒸馏水洗涤烧杯2~3次,并将洗涤液也全部转移到容量瓶中;
(5)继续向容量瓶中加蒸馏水,直到液面接近刻度线1~2cm处,改用胶头滴管逐滴加蒸馏水,至液面与刻度线相切
(6)盖好容量瓶塞,反复颠倒摇匀,将配好的稀硫酸倒入试剂瓶中,贴好标签保存。
试分析下列操作对实验结果的影响(偏高、偏低或无影响)
①没有洗涤烧杯和玻璃棒
②定容时俯视读数
③容量瓶使用前有少许水残留
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语或模型正确的是( )
A. CH4分子的比例模型:![]() B. 乙醇的结构简式:C2H6O
B. 乙醇的结构简式:C2H6O
C. Al3+的结构示意图:![]() D. 氯化钙的电离方程式:CaCl2===Ca2++Cl2-
D. 氯化钙的电离方程式:CaCl2===Ca2++Cl2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年10月15日,中国用“长征三号乙”运载火箭成功以“一箭双星”方式发射北斗三号全球组网卫星系统第15、16号卫星,其火箭推进剂为高氯酸铵(NH4ClO4)等。制备NH4ClO4的工艺流程如下:
饱和食盐水![]() NaClO3
NaClO3![]() NaClO4
NaClO4![]() NaClO4
NaClO4![]() NH4ClO4
NH4ClO4
下列说法错误的是( )
A. NH4ClO4属于离子化合物
B. 溶解度:NaClO4>NH4ClO4
C. 该流程中可循环利用的物质是NH4Cl
D. 高氯酸铵中氯元素的化合价为+7价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
A.0.01molNH4+含有质子数为0.1NA
B.4.48 L N2与CO的混合物所含分子数为0.2NA
C.6.2 g白磷与红磷的混合物中所含磷原子数为0.2NA
D.10.0mL 12 mol·L-1浓盐酸与足量二氧化锰反应,转移电子数为0.06NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com