
【题目】某课外活动小组利用下列化学反应在实验室中制备氯气,并进行有关氯气性质的研究。MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(1)该小组同学欲用下图所示仪器及试剂(不一定全用)制备并收集纯净、干燥的氯气。


①应该选择的仪器是________(填字母)。
②浓盐酸与二氧化锰反应的离子方程式为____________________________
(2)该小组同学设计并分别利用下图所示装置探究氯气的氧化性。

①G中的现象是________,原因是__________________(用化学方程式表示)。
②H中的现象是__________________。
【答案】ACDBE MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O 溶液由无色变为蓝色 Cl2+2KI=I2+2KCl 产生白色沉淀
Mn2++Cl2↑+2H2O 溶液由无色变为蓝色 Cl2+2KI=I2+2KCl 产生白色沉淀
【解析】
MnO2与浓盐酸在加热条件下反应制取氯气,制取的氯气中含有杂质HCl、水蒸气,先通过饱和食盐水除去杂质HCl,然后通过浓硫酸干燥氯气,然后利用氯气的密度比空气大,用向上排空气的方法收集,就得到干燥纯净的氯气,氯气是大气污染物,根据氯气能够与强碱溶液反应的性质用NaOH溶液吸收多余的氯气,进行尾气处理。利用活动性强的可以将活动性弱的从相应的盐中置换出来,然后根据I2遇淀粉溶液变为蓝色,验证氯气的强氧化性,可以根据氯气具有氧化性,也可以通过在溶液中将SO2氧化为硫酸,根据硫酸与可溶性钡盐反应产生难溶性的BaSO4白色沉淀来检验氯气的强氧化性。
(1) ①利用MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O,在A中制取Cl2,由于浓盐酸具有挥发性,制取得到的氯气中含有杂质HCl、水蒸气,先通过C装置用饱和食盐水除去杂质HCl气体,然后再通过D装置用浓硫酸来干燥氯气,根据氯气的密度比空气大,用B装置采用向上排空气的方法收集氯气,由于氯气是有毒的气体,会造成大气污染,所以在排放前要进行尾气处理,根据Cl2+2NaOH=NaCl+NaClO+H2O,通过E装置进行尾气处理,因此使用装置的先后顺序为A、C、D、B、E;
MnCl2+Cl2↑+2H2O,在A中制取Cl2,由于浓盐酸具有挥发性,制取得到的氯气中含有杂质HCl、水蒸气,先通过C装置用饱和食盐水除去杂质HCl气体,然后再通过D装置用浓硫酸来干燥氯气,根据氯气的密度比空气大,用B装置采用向上排空气的方法收集氯气,由于氯气是有毒的气体,会造成大气污染,所以在排放前要进行尾气处理,根据Cl2+2NaOH=NaCl+NaClO+H2O,通过E装置进行尾气处理,因此使用装置的先后顺序为A、C、D、B、E;
②制取氯气的反应MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O改写为离子形式,根据物质的存在状态及离子方程式拆分原则,可得相应的离子方程式为MnO2+4H++2Cl-
MnCl2+Cl2↑+2H2O改写为离子形式,根据物质的存在状态及离子方程式拆分原则,可得相应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O;
Mn2++Cl2↑+2H2O;
(2)①将氯气通入到含有淀粉KI溶液的G试管中,由于氧化性Cl2>I2,所以会发生反应:Cl2+2KI=I2+2KCl,反应产生的I2遇淀粉溶液变为蓝色,所以看到的现象是溶液由无色变为蓝色;
②将氯气通入到溶有SO2气体的BaCl2溶液的H中,发生反应:Cl2+SO2+2H2O=H2SO4+2HCl,反应产生的硫酸会进一步发生反应:BaCl2+H2SO4=BaSO4↓+2HCl,因此会看到H中的现象是产生白色沉淀。


 一本好题口算题卡系列答案
一本好题口算题卡系列答案科目:高中化学 来源: 题型:
【题目】N2O5是一种新型硝化剂,在一定温度下可发生如下反应:2N2O5(g)![]() 4NO2(g)+O2(g) △H>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
4NO2(g)+O2(g) △H>0。T1温度时,向密闭容器中通入N2O5气体,部分实验数据见下表:
时间/s | 0 | 500 | 1000 | 1500 |
c(N2O5)/(mol·L—1) | 5.00 | 3.52 | 2.50 | 2.50 |
下列说法正确的是
A. 500s内O2的平均生成速率为7.4×l0—4mol·L—1·s—1
B. T1温度下该反应达到平衡时,平衡混合物中NO2的体积分数为50%
C. 达到平衡后,其他条件不变,将容器体积压缩到原来的1/2,则c(N2O5)>5.00mol·L—1
D. T1温度下的平衡常数为K1,T2温度下的平衡常数为K2,若K1<K2,则T1>T2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酰氯(ClNO)是有机合成中的重要试剂。可通过反应获得:2NO(g)+Cl2(g) ![]() 2ClNO(g)
2ClNO(g)
(1)氢氧化物与悬浮在大气中的海盐粒子相互作用时会生成亚硝酰氯,涉及如下反应:
①2NO2(g)+NaCl(s) ![]() NaNO3(s)+ClNO(g) K1
NaNO3(s)+ClNO(g) K1
②4NO2(g)+2NaCl(s) ![]() 2NaNO3(s)+2NO(g)+Cl2(g) K2
2NaNO3(s)+2NO(g)+Cl2(g) K2
③2NO(g)+Cl2(g) ![]() 2ClNO(g) K3
2ClNO(g) K3
则K3=______________(用K1和K2表示)。
(2)按投料比[n(NO):n(Cl2)=2:1]把NO和Cl2加入到一恒压的密闭容器中发生反应,平衡时NO的转化率与温度T、压强P(总压)的关系如图A所示:
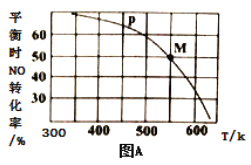
①该反应的△H______0(填“>”“<”或“=”);
②在P压强条件下,M点时容器内NO的体积分数为_________;
③若反应一直保持在P压强条件下进行,则M点的分压平衡常数Kp=__________(用含P的表达式表示,用平衡分压代替平衡浓度计算,分压=总压×体积分数)。
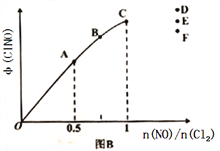
(3)一定条件下在恒温恒容的密闭容器中按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数的变化图像如图B,则A、B、C三状态中,NO的转化率最大的是_________点;当n(NO)/n(Cl2)=1.5时,达到平衡状态ClNO的体积分数可能是D、E、F三点中的_____________点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物H可用以下路线合成:
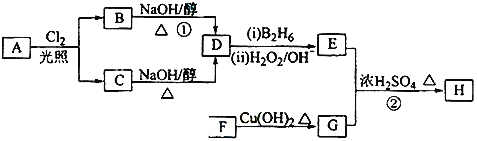
已知:![]()
回答下列问题:
(1)11.2L(标准状况)的烃A在氧气中充分燃烧可以生成88g CO2和45g H2O,且A分子结构中有3个甲基,则A的结构简式为______________;
(2)B和C均为一氯代烃,D的名称(系统命名)为_______________;
(3)在催化剂存在下1mol F与2mol H2反应,生成3﹣苯基﹣1﹣丙醇.F的结构简式 是_________________________________________________________________________;
(4)反应①的反应类型是_________________________________________________________;
(5)反应②的化学方程式为______________________________________________________;
(6)写出与G具有相同官能团的芳香类的G的同分异构体的结构简式___________________.(任写一种。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用元素的化合价推测物质的性质是化学研究的重要手段。如图是硫元素的常见化合价与部分物质类别的对应关系:
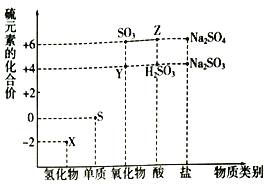
(1)从硫元素化合价变化的角度分析,图中既有氧化性又有还原性的化合物有______________(填化学式)((填一种就可以)。
(2)将X与Y混合,可生成淡黄色固体。该反应中氧化剂与还原剂的物质的量之比为_______________。
(3) Z的浓溶液与铜单质在一定条件下可以发生化学反应,该反应的化学方程式为____________。
(4)Na2S2O3是重要的化工原料.从氧化还原反应的角度分析,下列制备Na2S2O3的方案理论上可行的是_____________(填字母)。
a.Na2S+S b.Na2SO3+S c.SO2+Na2SO4 d.Na2SO3+Na2SO4
(5)已知Na2SO3能被K2Cr2O7氧化为Na2SO4,则24 mL 0.05 mol/L的Na2SO3溶液与 20 mL 0.02 mol/L的溶液恰好反应时,Cr元素在还原产物中的化合价为____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】简单原子的原子结构可用下图形象地表示:
![]()
其中“●”表示质子或电子,“○”表示中子,则下列有关①②③的叙述正确的是( )
A. ①②③是三种不同的氢分子B. ①②③互为同位素
C. ①②③是三种化学性质不同的粒子D. ①②③具有相同的质量数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中,错误的是( )
A.Fe(OH)3胶体常用来净水
B.“血液透析”利用了胶体的性质
C.光束通过硫酸铜溶液可看到丁达尔现象
D.胶体与溶液的本质区别是分散质粒子直径的大小不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA代表阿伏加德罗常数的值。下列说法正确的是
A. 常温常压下,124 g P4中所含P—P键数目为4NA
B. 100 mL 1mol·L1FeCl3溶液中所含Fe3+的数目为0.1NA
C. 标准状况下,11.2 L甲烷和乙烯混合物中含氢原子数目为2NA
D. 密闭容器中,2 mol SO2和1 mol O2催化反应后分子总数为2NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com