
【题目】砷(As)是第四周期第VA族元素,它在自然界中的含量不高,但人类认识它、研究它的历史却很长。
(1)已知H3AsO3是两性偏酸性的化合物,H3AsO3中As的化合价为_____,它与足量硫酸反应时生成盐的化学式为_______________。Na2HAsO3溶液呈碱性,原因是_________________(用离子方程式表示),该溶液中c(H2AsO3-) _____c(AsO33-)(填”>”、“<”或“=”)。
(2)砷在自然界中主要以硫化物形式(如雄黄As4S4、雌黄As2S3等)存在。
①工业上以雄黄为原料制备砷、鉴定砒霜(As2O3)的原理如下图:

反应a产生的废气直接排放可能带来的环境问题是__________ _____,请写出反应b的化学方程式:_________________________。
②雌黄可被浓硝酸氧化为H3AsO4与S,硝酸被还原为NO2,反应中还原剂与氧化剂物质的量之比为_________。
③向c(As3+)=0.01mol/L的工业废水中加入FeS固体至砷完恰好完全除去(小于1×10-5mol/L),则此时c(Fe2+)=_____mol/L。(已知Ksp(As2S3)=1×10-22,Ksp(FeS)=6×10-18)
(3)某原电池装置如右图,电池总反应为AsO43-+2I-+H2O![]() AsO33-+I2+2OH-当P池中溶液由无色变成蓝色时,正极上的电极反应式为_______________。当电流计指针归中后向Q池中加入一定量的NaOH,则电子由_____(填“P”或“Q”)池流出。
AsO33-+I2+2OH-当P池中溶液由无色变成蓝色时,正极上的电极反应式为_______________。当电流计指针归中后向Q池中加入一定量的NaOH,则电子由_____(填“P”或“Q”)池流出。

【答案】(1)+3,As2(SO4)3。HAsO32-+H2O ![]() H2AsO3-+OH-, >
H2AsO3-+OH-, >
(2)① 造成硫酸型酸雨 As2O3+6Zn+6H2SO4= 2AsH3 ↑+ 6ZnSO4+ 3H2O
②1:10 ③6×10-14(3)AsO43-+H2O+2e-= AsO33-+2OH- Q
【解析】
试题分析:(1)根据H3AsO3的化学式和化合价的代数和等于零可知,As的化合价为2×3-1×3=+3价;H3AsO3是两性偏酸性的化合物,它与足量硫酸反应时体现碱的性质,即生成硫酸盐:As2(SO4)3;Na2HAsO3是弱酸的酸式盐,溶液呈碱性,说明HAsO32-的水解程度大于其电离程度,则Na2HAsO3溶液呈碱性的原因是HAsO32-+H2O ![]() H2AsO3-+OH-,因为H3AsO3是多元弱酸,电离分部进行,且二级电离产生的H+对三级电离起抑制作用,所以该溶液中c(H2AsO3-)>c(AsO33-)。
H2AsO3-+OH-,因为H3AsO3是多元弱酸,电离分部进行,且二级电离产生的H+对三级电离起抑制作用,所以该溶液中c(H2AsO3-)>c(AsO33-)。
(2)①雄黄的成分是As4S4,雄黄在空气中煅烧生成砒霜(As2O3)和SO2,产生的废气SO2直接排放带来的环境问题是造成硫酸型酸雨;砒霜(As2O3)和锌、稀硫酸反应生成AsH3↑、硫酸锌和水,反应的化学方程式为As2O3+6Zn+6H2SO4= 2AsH3 ↑+ 6ZnSO4+ 3H2O。
②雌黄可被浓硝酸氧化为H3AsO4与S,硝酸被还原为NO2,根据得失电子守恒和原子守恒配平,反应的化学方程式为As2S3+10HNO3 =2H3AsO4+3S+10NO2↑+2H2O,反应中还原剂是As2S3,氧化剂是硝酸,则还原剂与氧化剂的物质的量之比为1:10。
③根据Ksp(As2S3)=1×10-22,(10-5)2×c(S2-)3=1×10-22,c(S2-)=10-4mol/L,因为Ksp(FeS)=6×10-18,则10-4×c(Fe2+)=6×10-18,c(Fe2+)= 6×10-14。
(3)根据原电池总反应AsO43-+2I-+H2O![]() AsO33-+I2+2OH-,当P池中溶液由无色变成蓝色时,说明P池有I2生成,即上述可逆过程向右进行,I-失电子生成I2,I-在负极放电,则正极上的电极反应式为AsO43-+H2O+2e-= AsO33-+2OH-。当电流计指针归中后向Q池中加入一定量的NaOH,导致上述平衡逆向移动,AsO33-失电子生成AsO43-,则电子由Q池流出。
AsO33-+I2+2OH-,当P池中溶液由无色变成蓝色时,说明P池有I2生成,即上述可逆过程向右进行,I-失电子生成I2,I-在负极放电,则正极上的电极反应式为AsO43-+H2O+2e-= AsO33-+2OH-。当电流计指针归中后向Q池中加入一定量的NaOH,导致上述平衡逆向移动,AsO33-失电子生成AsO43-,则电子由Q池流出。


科目:高中化学 来源: 题型:
【题目】钛铁矿的主要成分为FeTiO3(可表示为FeO·TiO2),含有少量MgO、SiO2等杂质。利用钛铁矿制备二氧化钛,进一步制备钛单质,流程如图:

已知:FeTiO3+4H+=Fe2++TiO2++2H2O,草酸(H2C2O4)具有很强还原性,易被氧化成二氧化碳。
(1)化合物FeTiO3中铁元素的化合价是 。
(2)钛铁矿加入过量H2SO4后,得到的滤渣A为______ _________(填化学式)。
(3)含TiO2+ 溶液乙转化生成TiO2的离子方程式是 。
(4)由滤液丙制备LiFePO4的过程中,所需17%双氧水与H2C2O4的质量比是 。
(5)用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定Ti3+至全部生成Ti4+。滴定分析时,称取TiO2(摩尔质量为Mg/mol)试样wg,消耗c mol/L NH4Fe(SO4)2标准溶液VmL,则TiO2质量分数为 (用代数式表示)。
(6)TiO2制取单质Ti,涉及到的步骤如下:![]()
TiCl4 | Mg | MgCl2 | Ti | |
熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
反应②的方程式是___ ____。由TiCl4→Ti需要在Ar气中进行的理由是___ _______。反应后得到Mg、MgCl2、Ti的混合物,可采用真空蒸馏的方法分离得到Ti,依据表中信息,需加热的温度略高于 ℃即可。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知非金属单质硫(S)是淡黄色固体粉末,难溶于水。为了验证氯元素的非金属性比硫元素的非金属性强,某化学实验小组设计了如下实验,请回答下列问题:

(1)装置A的分液漏斗中盛装的试剂是 ,烧瓶中加入的试剂是 。
(2)虚线框内的实验装置的作用 。
(3)装置B中盛放的试剂是 (选填下列所给试剂的代码),实验现象为 ,化学反应方程式是 ,该反应属于四种基本反应类型中的 _______反应。
A.Na2S溶液 B.Na2SO3溶液 C.Na2SO4溶液
(4)还有哪些事实能够说明氯元素的非金属性比硫元素的非金属性强(试举一例)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学—选修5有机化学基础】
高分子材料PET聚酯树脂和PMMA的合成路线如下:

已知:
Ⅰ. RCOOR’+ R”18OH![]() RCO18OR”+R’OH(R、R’、R”代表烃基)
RCO18OR”+R’OH(R、R’、R”代表烃基)
![]()
![]() Ⅱ.
Ⅱ.  (R、R’代表烃基)
(R、R’代表烃基)
(1)①的反应类型是________。
(2)②的化学方程式为________。
(3)PMMA单体的官能团名称是________、________。
(4)F的核磁共振氢谱显示只有一组峰,⑤的化学方程式为________。
(5)G的结构简式为________。
(6)下列说法正确的是________(填字母序号)。
a.⑦为酯化反应
b.B和D互为同系物
c.D的沸点比同碳原子数的烷烃高
d. 1 mol 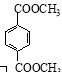 与足量NaOH溶液反应时,最多消耗4 mol NaOH[
与足量NaOH溶液反应时,最多消耗4 mol NaOH[
(7)写出由PET单体制备PET聚酯并生成B的化学方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在一个容积不变的密闭容器中,发生反应:2NO(g)+O2(g)![]() 2NO2(g) 当n(NO):n(O2)=4:1时, O2的转化率随时间的变化关系如右图1所示。
2NO2(g) 当n(NO):n(O2)=4:1时, O2的转化率随时间的变化关系如右图1所示。
①A点的逆反应速率v逆(O2)_____B点的正反应速率v正(O2)。(填“大于”、“小于”或“等于” )。
②NO的平衡转化率为______;当达到B点后往容器中再以4:1加入一些NO和O2,当达到新平衡时,则NO的百分含量_______B点NO的百分含量(填“大于”、“小于”或“等于” )。
(2)在下图2和图3中出现的所有物质都为气体,分析图1和图2,可推测:
4NO(g)+3O2(g)="2" N2O5(g) △H=_________

(3)若往20mL 0.0lmol/L的弱酸HNO2溶液中逐滴加入一定浓度的烧碱溶液,测得混合溶液的温度变化如图4所示,下列有关说法正确的是_______。
①该烧碱溶液的浓度为0.02mol/L
②该烧碱溶液的浓度为0.01mol/L
③HNO2的电离平衡常数:b点>a点
④从b点到c点,混合溶液中一直存在:c(Na+)>c(NO![]() )>c(OH
)>c(OH![]() )> c(H+)
)> c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】【化学——选修5:有机化学基础】(15分)醋硝香豆素是一种治疗心脑血管疾病的药物,能阻碍血栓扩展,其结构简式为: 。醋硝香豆素可以通过以下方法合成(部分反应条件省略)。
。醋硝香豆素可以通过以下方法合成(部分反应条件省略)。

已知: + H2O
+ H2O
回答以下问题:
(1)反应①的反应类型是 ;从A到B引入的官能团名称是 。
(2)反应②的条件是 。
(3)反应③的化学方程式为 。
(4)关于E物质,下列说法正确的是 (填字母序号)。
a.在核磁共振氢谱中有四组吸收峰
b.可以用酸性高锰酸钾溶液鉴别D和E
c.可以发生加成反应、聚合反应、氧化反应和还原反应
d.存在顺反异构
(5)写出G的结构简式 。
(6)分子结构中只含有一个环,且同时符合下列条件的G的同分异构体共有 种。
①可与氯化铁溶液发生显色反应; ②可与碳酸氢钠溶液反应生成二氧化碳气体。
其中,苯环上的一氯代物只有两种的同分异构体的结构简式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硝基苯是重要的化工原料,用途广泛。制备反应如下:
![]()

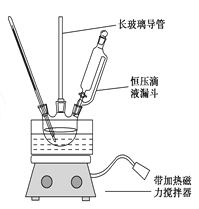
组装如右上图反应装置。 制备、提纯硝基苯流程如下:

可能用到的有关数据列表如下:
物 质 | 熔点/℃ | 沸点/℃ | 密度(20 ℃)/g · cm-3 | 溶解性 |
苯 | 5.5 | 80 | 0.88 | 微溶于水 |
硝基苯 | 5.7 | 210.9 | 1.205 | 难溶于水 |
浓硝酸 | — | 83 | 1.4 | 易溶于水 |
浓硫酸 | — | 338 | 1.84 | 易溶于水 |
请回答下列问题:
(1)配制混酸应在烧杯中先加入 ;实验装置中长玻璃管最好用________代替(填仪器名称);恒压滴液漏斗的优点是 。
(2)反应温度控制在50~60 ℃的原因是 ;反应结束后产物在 层(填“上”或者“下”),步骤②分离混酸和产品的操作名称是 。
(3)用Na2CO3溶液洗涤之后再用蒸馏水洗涤时,怎样验证液体已洗净? 。
(4)固体D的名称为 。
(5)用铁粉、稀盐酸与硝基苯(用Ph-NO2表示 )反应可生成染料中间体苯胺(Ph-NH2),其反应的化学方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】[化学—选修2:化学与技术]粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物组成为SiO2、Al2O3、CaO等。一种利用粉煤灰制取氧化铝的工艺流程如下:
(1)粉煤灰研磨的目的是_______________________。
(2)第1次过滤时滤渣的主要成分有__________、__________(填化学式,下同),第3次过滤时滤渣的成分是__________。
(3)在104℃用硫酸浸取时,铝的浸取率与时间关系如图1,适宜的浸取时间为__________h;铝的浸取率与![]() 的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在
的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在![]() 相同时,浸取率最高的是__________(填助溶剂化学式);用含氟的化合物作这种助溶剂的缺点是__________(举一例)。
相同时,浸取率最高的是__________(填助溶剂化学式);用含氟的化合物作这种助溶剂的缺点是__________(举一例)。

(4)流程中循环使用的物质有__________。(填化学式)
(5)用盐酸溶解硫酸铝晶体,再通入HCl气体,析出AlCl3·6H2O,请简要说明该过程能够发生的原因____________________。
(6)用粉煤灰制取含铝化合物的主要意义是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以乙烯为原料合成化合物C的流程如图所示:

(1)A和B中含有的官能团名称分别为___ _____,____________。
(2)写出A的结构简式:____________ ___________。
(3)①③的反应类型分别为______ __反应和____ ____反应。
(4)写出乙醇的同分异构体的结构简式:______________ ______。
(5)写出反应②和③的化学方程式:
②____________________________;④_____________________________。
(6)写出B与新制Cu(OH)2悬浊液反应的化学方程式:_____ ___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com