
| A. |  | |
| B. | 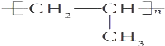 | |
| C. | 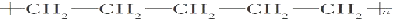 | |
| D. | 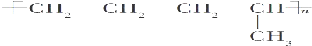 |
分析 凡含有不饱和键(双键、叁键、共轭双键)的化合物或环状低分子化合物,在催化剂、引发剂或辐射等外加条件作用下,相互加成形成新的共价键相连大分子的反应就是加聚反应.可以是同物质之间加成聚合也可是不同物质间加成聚合.不同物质发生加聚反应,注意原子的连接顺序,以此解答该题.
解答 解:乙烯和丙烯中都双键,发生加聚反应时,可以是乙烯和乙烯之间发生加聚反应,可以是丙烯和丙烯之间发生加聚反应,也可以是乙烯和丙烯之间发生加聚反应;
如果是乙烯和乙烯之间发生加聚反应生成聚乙烯,结构简式为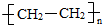 ,即为A结构,
,即为A结构,
如果是丙烯和丙烯之间发生加聚反应是聚丙烯,结构简式为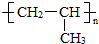 ,即为B结构
,即为B结构
如果是乙烯和丙烯之间发生加聚反应,由于碳原子之间的连接顺序可以有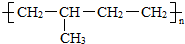 和
和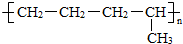 两种结构简式,分别为D结构.
两种结构简式,分别为D结构.
故选:C.
点评 本题考查有机物的结构和性质,为高频考点,侧重学生的分析能力的考查,注意由单体判断高聚物的结构,难度不大,知道根据高聚物判断单体的方法.


 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
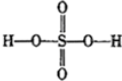 过硫酸:
过硫酸: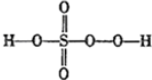
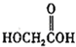 (b)
(b)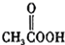 (c)H2O2(d)
(c)H2O2(d) (e)
(e) (f)
(f)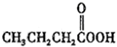 (g)O3(h)
(g)O3(h)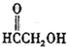
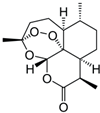
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CH2Cl-CH2Cl 二氯乙烷 | B. | 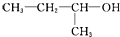 1-甲基-1-丙醇 1-甲基-1-丙醇 | ||
| C. | 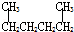 1,4-二甲基丁烷 1,4-二甲基丁烷 | D. | 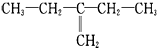 2-乙基-1-丁烯 2-乙基-1-丁烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 12C与14C | B. | CH3CH2OH与CH3COOH | ||
| C. | 甲烷与丙烷 | D. | CH3CH2CH2CH3与CH3CH(CH3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
| 2 | ⑥ | ⑦ | ||||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ | |||
| 4 | ② | ④ | ⑨ |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com