


科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
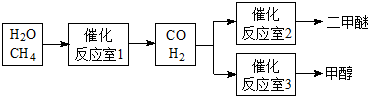
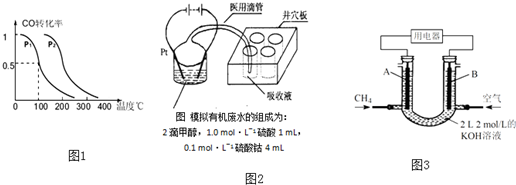
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O2用作呼吸面具的供氧剂 |
| B、工业上电解熔融状态的Al2O3制备Al |
| C、工业上利用热纯碱溶液清洗油污 |
| D、用焰色反应鉴定是否有钾元素存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,11.2L的戊烷所含的分子数为0.5 NA |
| B、26g乙炔所含共用电子对数目为3 NA |
| C、标准状况下,11.2 L CCl4所含分子数为0.5 NA |
| D、现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3 NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com