
【题目】二甲醚是一种重要的清洁燃料。合成二甲醚是解决能源危机的研究方向之一。
(1)用CO2和H2可以合成二甲醚(CH3OCH3)。
已知:CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.1 kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-41.1 kJ·mol-1
2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH3=-24.5 kJ·mol-1
则反应2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)ΔH=________。
(2)二甲醚(CH3OCH3)燃料电池可以提升能量利用率。利用二甲醚酸性介质燃料电池电解200 mL饱和食盐水(惰性电极),一段时间后,阴极收集到标况下的氢气2.24 L(设电解后溶液体积不变)。
①二甲醚燃料电池的正极反应式为:___________,负极反应式为:_____________。
②请写出电解食盐水的化学方程式:____________________。
③电解后溶液的c(OH-)=________,理论上消耗二甲醚的质量为________(保留一位小数)。
【答案】-122.5 kJ·mol-1 3O2+12H++12e-=6H2O CH3OCH3+3H2O-12e-=2CO2+12H+ 2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑ 1 mol·L-1 0.8 g
2NaOH+H2↑+Cl2↑ 1 mol·L-1 0.8 g
【解析】
(1)首先写出反应的化学方程式,然后利用盖斯定律计算所需热化学方程式;
(2)①原电池负极发生氧化反应,二甲醚在负极放电,酸性条件下生成二氧化碳碳,正极是氧气得到电子在酸性溶液中生成水,结合电荷守恒和原子守恒书写电极反应;
②电极饱和食盐水生成氢氧化钠、氯气和氢气;
③根据电解氯化钠溶液的电解方程式来计算溶液中的OH-的物质的量,然后根据物质的量浓度与物质的量关系式计算溶液中c(OH-),结合电极反应和电子守恒计算消耗二甲醚的质量。
(1)利用盖斯定律进行计算,将三个方程式进行形式变换。
①CO(g)+2H2(g)=CH3OH(g) ΔH1=-90.1 kJ·mol-1
②CO(g)+H2O(g)=CO2(g)+H2(g) ΔH2=-41.1 kJ·mol-1
③2CH3OH(g)=CH3OCH3(g)+H2O(g) ΔH3=-24.5 kJ·mol-1
根据盖斯定律,①×2-2×②+③整理可得:2CO2(g)+6H2(g)=CH3OCH3(g)+3H2O(g)ΔH=-122.5 kJmol-1;
(2)①正极上是氧气得到电子发生还原反应,在酸性溶液中生成生成水,电极反应为:O2+4e-+4H+=2H2O,也可写为:3O2+12H++12e-=6H2O;在负极上二甲醚失去电子发生氧化反应,酸性条件下生成二氧化碳,电极反应式为:CH3OCH3-12e-+3H2O=2CO2+12H+;
②电极饱和食盐水阳极氯离子失电子发生氧化反应生成氯气,阴极氢离子得到电子发生还原反应生成氢气,同时溶液中生成氢氧化钠,反应的化学方程式为:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
③由方程式:2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑可知:之后反应为直接电解水,n(H2)=
2NaOH+H2↑+Cl2↑可知:之后反应为直接电解水,n(H2)=![]() =0.1mol,则根据方程式可知n(NaOH)=2n(H2)=0.2mol,由于溶液的体积是0.2L,所以c(NaOH)=0.2mol÷0.2L=1mol/L;
=0.1mol,则根据方程式可知n(NaOH)=2n(H2)=0.2mol,由于溶液的体积是0.2L,所以c(NaOH)=0.2mol÷0.2L=1mol/L;
电解过程中电子转移总数为0.2mol,结合电极反应和电子守恒计算CH3OCH3+3H2O-12e-=2CO2+12H+,消耗甲醚物质的量n(CH3OCH3)=![]() mol,其质量为m(CH3OCH3)=
mol,其质量为m(CH3OCH3)=![]() mol×46g/mol=0.8g。
mol×46g/mol=0.8g。


科目:高中化学 来源: 题型:
【题目】核酸检测对防疫新冠肺炎意义重大。下图1是脱氧核糖核酸(DNA)的结构片段,它的碱基中胞嘧啶的结构如图2,下列说法正确的是
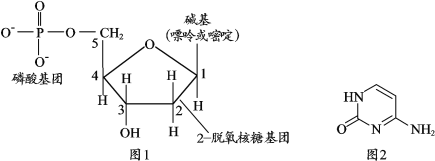
A.脱氧核糖核酸中含有的化学键都是不同原子形成的极性共价键
B.2-脱氧核糖(C5H10O4)与葡萄糖属于同系物,都能发生银镜反应
C.胞嘧啶分子式为C4H5N3O,含有的官能团是氨基和肽键
D.脱氧核糖核酸由磷酸、2-脱氧核糖和碱基通过一定方式结合而成
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A. 已知2SO2(g)+O2(g)![]() 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B. 若C(石墨,s)=C(金刚石,s) ΔH>0,则石墨比金刚石稳定
C. 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.4 kJ·mol-1,则20.0 g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量
D. 已知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于下列各装置图的叙述不正确的是( )


A.用图①装置实现铁上镀铜,a极为铜,电解质溶液可以是CuSO4溶液
B.图②装置盐桥中KCl的Cl-移向右烧杯
C.图③装置中钢闸门应与外接电源的负极相连获得保护
D.图④两个装置中通过导线的电子数相同时,消耗负极材料的物质的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:

下列叙述正确的是( )
A.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
B.反应①、过滤后所得沉淀为氢氧化铁
C.图中所示转化反应都不是氧化还原反应
D.试剂X可以是氢氧化钠溶液,也可以是盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究铁和硫反应产物中铁的化合价,某同学设计了如下所示的实验过程:
![]()
已知:①铁和硫反应产物不溶于碱,能溶于硫酸
②硫可溶于热碱溶液,发生类似于 Cl2 和 NaOH 溶液的化学反应下列说法不正确的是
A.混合粉末应在 N2 氛围中进行加热,所用 H2SO4 溶液应先煮沸
B.取溶液 A,滴加 KSCN 溶液,未出现红色,可证明铁和硫反应只有+2 价铁生成
C.滤渣用稀 H2SO4 溶解时应在通风橱中进行
D.硫溶于热碱溶液可能发生的离子反应是3S+6OH-![]() 2S2-+SO32-+3H2O
2S2-+SO32-+3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g) ![]() 2C(g)+D(g),经2 min B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是
2C(g)+D(g),经2 min B的浓度减少0.6 mol·L-1。对此反应速率的正确表示是
A. 用A表示的反应速率是0.8 mol·L-1·s-1
B. 分别用B、C、D表示反应的速率,其比值是3∶1∶2
C. 在2 min末时的反应速率,用产物C来表示是0.2mol·L-1·min-1
D. 在这2 min内用B和C表示的反应速率的值都是不同的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学研究性学习小组为学习了元素性质后,分别设计了如下实验:
(1)甲同学想探究“铝热反应”中熔融物的成份,他查阅《化学手册》得到Al、Al2O3、Fe、Fe2O3熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2054 | 1535 | 1462 |
沸点/℃ | 2467 | 2980 | 2750 | …… |
①由此甲同学推测,教材中铝热反应所得到的熔融物应是铁铝合金。其理由是:_______________。
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝,该实验所用试剂是___,反应的离子方程式为_____。
③甲同学为确定熔融物中是否还会有残留的Fe2O3,将熔融物用酸完全溶解后加入KSCN试剂。请你分析该设计是否正确___(填“正确”或“不正确”),理由是(用离子方程式表示)______________________。
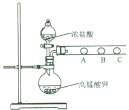
(2) 乙同学设计了如下图装置验证元素性质递变规律。A、B、C处分别是蘸有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润的红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。乙同学可能观察到的现象有_______。 从环保角度考虑,该装置有明显不足,请提出改进建议_____________________。
(3) 丙同学欲比较N、C、Si的非金属性强弱,设计了下图所示的实验装置,其设计能否达到实验目的______(填“能”或“不能”),理由是______________。 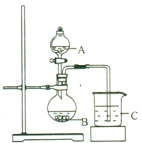
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com