
| 碳 | 氮 | Y | |
| X | 硫 | Z |
 .
.分析 (1)周期表中Z元素为氯元素,核电荷数为17,三个电子层,最外层7个电子;
(2)同周期原子半径依次减小,同主族原子半径依次增大;
(3)比较非金属元素的非金属性强弱,可根据单质之间的置换反应、对应最高价氧化物的水化物的酸性、氢化物的稳定性等角度判断,而与得失电子数没有必然关系;
(4)X(Si)与Z(Cl)两元素的单质反应生成1molX的最高价化合物SiCl48.5g,物质的量=$\frac{8.5g}{170g/mol}$=0.05mol,恢复至室温,放热34.35kJ,生成1molSiCl4放热687KJ,由于该化合物的熔、沸点分别为-69℃和58℃,则常温下SiCl4为液态,据此结合热化学方程式的书写原则解答;
(5)碳与铝形成的1mol化合物Q与水反应,生成4molAl(OH)3和3mol化合物L(仅含碳、氢两种元素),依据原子守恒和反应实质分析AlxCy+12H2O=4Al(OH)3+3L,原子守恒得到L为CH4,Q为Al4C3;
(6)H2Y2是实验室中的常用试剂,化学式为H2O2,其结构中存在的共价键有H-O和O-O共价键,在制备过程中要防止Fe3+的混入,理由是铁离子对过氧化氢分解起到催化剂作用.
解答 解:(1)周期表中Z元素为氯元素,核电荷数为17,三个电子层,最外层7个电子,位于周期表中第三周期,第ⅤⅡA族,
故答案为:第三周期,第ⅤⅡA族;
(2)表中元素为第二周期和三周期中的元素,依据同周期原子半径依次减小,同主族原子半径依次增大分析可知,元素的原子半径最大的是Si,
故答案为:Si;
(3)a.Y单质与H2S溶液反应,溶液变浑浊,说明氧气的氧化性比硫强,则说明Y元素的非金属性比S元素的非金属性强,故a正确;
b.在氧化还原反应中,1molY单质比1molS得电子多,氧化性强弱与得失电子数没有必然关系,故b错误;
c.元素的非金属性越强,氢化物的稳定性越强,Y和S两元素的简单氢化物受热分解,前者的分解温度高,说明Y的非金属性较强,故c正确;
故答案为:ac;
(4)X(Si)与Z(Cl)两元素的单质反应生成1molX的最高价化合物SiCl48.5g,物质的量=$\frac{8.5g}{170g/mol}$=0.05mol,恢复至室温,放热34.35kJ,生成1molSiCl4放热687KJ,已知该化合物的熔、沸点分别为-69℃和58℃,则常温下SiCl4为液态,该反应的热化学方程式为:Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol,
故答案为:Si(s)+2Cl2(g)=SiCl4(l)△H=-687kJ/mol;
(5)碳与铝形成的1mol化合物Q与水反应,生成4molAl(OH)3和3mol化合物L(仅含碳、氢两种元素),依据原子守恒和反应实质分析AlxCy+12H2O=4Al(OH)3+3L,原子守恒得到L为CH4,Q为Al4C3,L为甲烷,分子式为CH4,为正四面体结构,电子式为 ,故答案为:
,故答案为: ;
;
(6)H2Y2是实验室中的常用试剂,化学式为H2O2,其结构中存在的共价键有H-O和O-O共价键,为极性键和非极性键,在制备过程中要防止Fe3+的混入,理由是铁离子对过氧化氢分解起到催化剂作用,
故答案为:极性键和非极性键;铁离子对过氧化氢分解起到催化剂作用.
点评 本题考查了原子结构与元素周期律、元素周期表的关系及氧化还原反应的计算等知识,题目难度中等,明确元素周期表结构、元素周期律内容为结构件,注意掌握守恒思想在化学计算中的应用.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只有②④ | B. | 只有①② | C. | 只有①②③ | D. | ①②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验 编号 | 0.01mol•L-1酸性KMnO4溶液 | 0.1mol•L-1 H2C2O4溶液 | 水 | 反应温度/℃ | 反应时间/s |
| ① | 5.0mL | 5.0mL | 0 | 20 | 125 |
| ② | V1 | V2 | 2.0mL | 20 | 320 |
| ③ | 5.0mL | 5.0mL | 0 | 50 | 30 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2+2NH3+H2O═(NH4)2SO3 | |
| B. | NO2+NO+2NaOH═2NaNO2+H2O | |
| C. | Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O | |
| D. | CuO+H2SO4(稀)═CuSO4+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 无色溶液中:K+、Na+、MnO4-、SO42- | |
| B. | 在酸性溶液中:Mg2+、Na+、SO42-、Cl- | |
| C. | 加入 Al 能放出 H2的溶液中:Cl-、HCO3-、SO42-、NH4+ | |
| D. | 酸性溶液中:K+、Cl-、NO3-、Fe2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
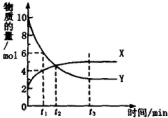
| A. | 反应的化学方程式为5Y?X | |
| B. | t1时,Y的浓度是X浓度的1.5倍 | |
| C. | t2时,正、逆反应速率相等,达到化学平衡 | |
| D. | t3时,逆反应速率大于正反应速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
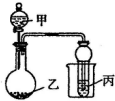 用如图所示装置进行实验,将少量液体甲逐滴加入到固体乙中,试管中试剂为丙,则下表中现象与结论均正确的是( )
用如图所示装置进行实验,将少量液体甲逐滴加入到固体乙中,试管中试剂为丙,则下表中现象与结论均正确的是( )| 选项 | 甲 | 乙 | 丙 | 试管中现象 | 结论 |
| A | 饱和食盐水 | 电石 | 酸性 KMnO4溶液 | 紫色褪去 | 乙炔发生氧化反应 |
| B | 稀盐酸 | 碳酸钠 | 澄清石灰水 | 溶液变浑浊 | 非金属性 Cl>C |
| C | 醋酸 | 碳酸钠 | 澄清石灰水 | 变浑浊 | 醋酸酸性强于碳酸 |
| D | 浓氨水 | 生石灰 | CuSO4溶液 | 蓝色略变深 | NH3与 CuSO4溶液不反应 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年陕西省高二上月考一化学卷(解析版)) 题型:选择题
对于任何一个化学平衡体系,以下变化或采取的措施,平衡一定发生移动的是
①加入一种反应物,②增大体系的压强,③升高温度,④使用催化剂,⑤化学平衡常数减小.
A.①②③⑤ B.①②③④⑤
C.③⑤ D.①②③
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com